题目内容
【题目】胆矾(CuSO4·5H2O)是铜的重要化合物,在工业生产中应用广泛。实验室制备胆矾的流程如下:

(1) 稀硫酸、稀硝酸与铜粉反应生成一种无色气体,该气体是_____(写化学式),制得的胆矾晶体中可能存在的杂质是_____(写名称)。
(2) 实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,步骤如下:
①取样、称量;②加水充分溶解;③加入BaCl2溶液;④过滤、洗涤、干燥;⑤称量、计算。在过滤前,需要检验SO42-是否沉淀完全,检验方法是____________________________________________
(3) 若改变反应条件可获得化学式为Cux(OH)y(SO4)z·nH2O的晶体,用热重分析仪对Cux(OH)y(SO4)z·nH2O晶体进行分析并推断该晶体的化学式。取3.30 g晶体样品进行热重分析,所得固体质量的变化曲线如下图所示。已知:体系温度在650 ℃及以下时,放出的气体只有水蒸气;实验测得温度在650 ℃时,残留固体的组成可视为aCuO·bCuSO4;温度在1 000 ℃以上时,得到的固体为Cu2O。
请回答下列问题:
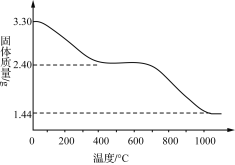
①温度650~1 000 ℃产生的气体中,n(O)∶n(S)____(填“>”“<”或“=”)3。
②通过计算推断Cux(OH)y(SO4)z·nH2O晶体的化学式:__________。
【答案】NO 硝酸铜 静置后,向上层清液中滴加少量BaCl2溶液,若无沉淀产生,则证明SO42-沉淀完全 > Cu2(OH)2SO4·4H2O
【解析】
(1)制硫酸铜时是用铜与硝酸、硫酸的混合物反应的,生成NO等,可根据反应物判断可能存在的杂质;
(2)在过滤前,需要检验SO42-是否沉淀完全,检验方法是:静置后,向上层清液中滴加少量BaCl2溶液,若无沉淀产生,则证明SO42-沉淀完全。
(3)①aCuO·bCuSO4温度在1 000 ℃以上时,得到的固体为Cu2O,生成SO3和O2,由此分析;
②n(Cu2O)=1.44g/144g·mol-1=0.01mol;
n(H2O)=(3.30g-2.40g)/18g·mol-1=0.05mol;
由2.4g固体的组成可视为aCuO·bCuSO4;有2.40g=80g·mol-1a+160g·mol-1b,由铜守恒,a+b=0.02mol,解得a=b=0.01mol;Cux(OH)y(SO4)z·nH2O中x:y:z:n=0.02:0.02:0.01:(0.05-0.02/2)=2:2:1:4。
(1)制硫酸铜时,是用铜与硝酸、硫酸的混合物反应的,生成NO等,铜与硝酸能生成硝酸铜,所以可能混有硝酸铜杂质,化学式为Cu(NO3)2。
(2)在过滤前,需要检验SO42-是否沉淀完全,检验方法是:静置后,向上层清液中滴加少量BaCl2溶液,若无沉淀产生,则证明SO42-沉淀完全。
(3)①aCuO·bCuSO4温度在1 000 ℃以上时,得到的固体为Cu2O,生成SO3和O2,温度650~1 000 ℃产生的气体中,n(O)∶n(S)>1:3;
②n(Cu2O)=1.44g/144g·mol-1=0.01mol;
n(H2O)=(3.30g-2.40g)/18g·mol-1=0.05mol;
由2.4g固体的组成可视为aCuO·bCuSO4;有2.40g=80g·mol-1a+160g·mol-1b,由铜守恒,a+b=0.02mol,解得a=b=0.01mol;Cux(OH)y(SO4)z·nH2O中x:y:z:n=0.02:0.02:0.01:(0.05-0.02/2)=2:2:1:4,化学式为Cu2(OH)2SO4·4H2O。