题目内容
【题目】实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
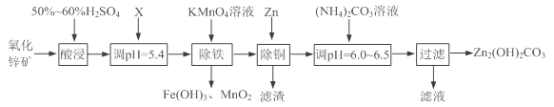
(1)“酸浸”时保持H2SO4过量的目的是___________。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:___________。
②流程中调节pH=5.4所加试剂X为____(填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由_____。
(3)上述流程中滤渣的成分为___________(写化学式);“滤液”可以用作化肥,该滤液的主要成分为___________(填化学式)。
(4)检验Zn2(OH)2CO3是否洗涤干净的方法是___________。
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为______。
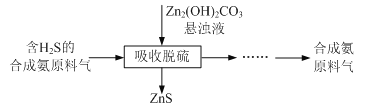
【答案】提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解) 3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+ ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等) 不能,强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀 Cu和Zn (NH4)2SO4 取最后一次洗涤液,向其中加入硝酸酸化的硝酸钡溶液,若无沉淀生成,说明沉淀洗涤干净 Zn2(OH)2CO3+2H2S=2ZnS↓+CO2↑+3H2O
【解析】
向氧化锌矿粉(主要含ZnO、FeCO3、CuO等)加入50%~60%硫酸酸浸,氧化锌矿粉溶解,得到溶液中含有Zn2+、Fe2+、Cu2+等金属离子,加入ZnO等调节溶液pH=5.4,然后加入高锰酸钾溶液发生氧化还原反应生成Fe(OH)3沉淀和MnO2沉淀,除铁后在滤液中加入过量Zn,除去铜,加入碳酸铵调节溶液pH6.0~6.5,生成Zn2(OH)2CO3。
(1)“酸浸”时保持H2SO4过量,可使固体充分溶解,且防止Zn2+、Fe2+、Cu2+等金属离子水解,故答案为:提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解);
(2)①由流程图可知,加入高锰酸钾溶液除铁时,Fe元素以氢氧化铁的形式除去,同时生成二氧化锰沉淀,则除铁的离子方程式是3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+,故答案为:3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+;
②向酸浸溶液中加入X调节溶液pH=5.4,目的是中和过量的硫酸调节溶液的pH又不能引入新的杂质,所以X只能是ZnO或碱式碳酸锌、碳酸锌、氢氧化锌等;试剂X与高锰酸钾不能互换,因为在酸性条件下,高锰酸根离子被还原为锰离子,而锰离子沉淀时的pH=8.1>5.4,此时Zn2+也会沉淀,所以不能互换,故答案为:ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等);不能,强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀;
(3)向除铁的滤液中加入过量Zn,用锌还原出铜离子,除去铜,过滤得滤渣为铜和过量的锌;加入碳酸铵调节pH6.0~6.5,可生成Zn2(OH)2CO3,同时生成(NH4)2SO4,(NH4)2SO4可用作化肥,故答案为:Cu和Zn;(NH4)2SO4;
(4)Zn2(OH)2CO3沉淀表面附有可溶性的(NH4)2SO4杂质,检验Zn2(OH)2CO3是否洗涤干净实际上就是检验洗涤液中不含有硫酸根,具体操作是取最后一次洗涤液,向其中加入硝酸酸化的硝酸钡溶液,若无沉淀生成,说明沉淀洗涤干净,故答案为:取最后一次洗涤液,向其中加入硝酸酸化的硝酸钡溶液,若无沉淀生成,说明沉淀洗涤干净;
(5)碱式碳酸锌吸收硫化氢后得到ZnS沉淀,同时又二氧化碳、水生成,过滤后可达到除硫的目的,反应的化学方程式为Zn2(OH)2CO3+2H2S=2ZnS↓+CO2↑+3H2O,故答案为:Zn2(OH)2CO3+2H2S=2ZnS↓+CO2↑+3H2O。