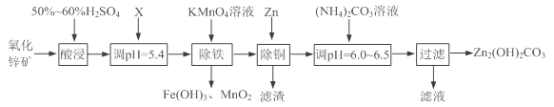
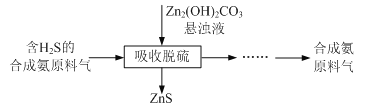
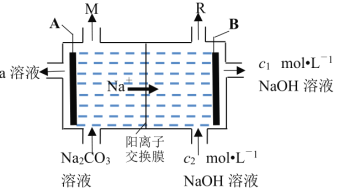
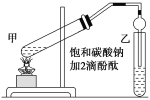
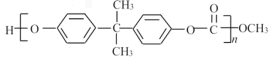
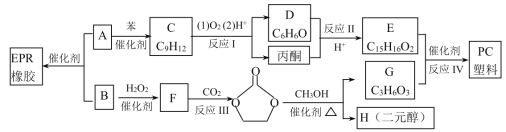
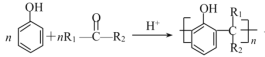
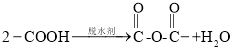
题目内容
【题目】在体积可变的密闭容器中投入0.5mol CO和1mol H2,不同条件下发生反应:![]() 。实验测得平衡时H2的转化率随温度、压强的变化如图1所示。下列说法错误的是( )
。实验测得平衡时H2的转化率随温度、压强的变化如图1所示。下列说法错误的是( )

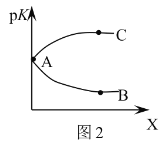
A.Y代表压强,且![]() ;X代表温度,且
;X代表温度,且![]()
B.M点反应物转化率之比![]() ,N点该比例减小
,N点该比例减小
C.若M、N两点对应的容器体积均为5L,则N点的平衡常数![]()
D.图2中曲线AB能正确表示该反应平衡常数的负对数![]() 与X的关系
与X的关系
【答案】BD
【解析】
A.若X为压强,Y为温度,由图可知相同温度下压强越大氢气的转化率越小,而该反应为气体体积减小的反应,相同温度下压强越大H2的转化率越大,所以Y为压强,X为温度,且![]() ;相同压强下温度越高,氢气的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应,即
;相同压强下温度越高,氢气的转化率越小,说明升高温度平衡逆向移动,正反应为放热反应,即![]() ,故A正确;
,故A正确;
B.初始投料n(CO):n(H2)=1:2,根据方程式可知反应过程中CO和H2按照1:2反应,所以任意时刻二者的转化率之比均为1:1,故B错误;
C.N点和M点温度相同,则平衡常数相同,容器体积为5L,M点H2的转化已知,为50%,可根据该点列三段式

根据平衡常数的定义可知K=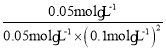 =
=![]() ,故C正确;
,故C正确;
D.![]() ,则K越大,pK越小,该反应正反应为放热反应,温度越高K越小,则pK越大,故曲线AC表示该反应平衡常数的负对数
,则K越大,pK越小,该反应正反应为放热反应,温度越高K越小,则pK越大,故曲线AC表示该反应平衡常数的负对数![]() 与X的关系,故D错误;
与X的关系,故D错误;
故答案为BD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20℃)AgCl:1.5×10-4g Ag2SO4:0.796 g
(1)甲同学的实验如下:
序号 | 操作 | 现象 |
实验Ⅰ | 将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中 | 产生白色沉淀,随后有黑色固体产生 |
取上层清液,滴加KSCN 溶液 | 溶液变红 |
注:经检验黑色固体为Ag
① 白色沉淀的化学式是_____________。
② 甲同学得出Ag+氧化了Fe2+的依据是_______________。
(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
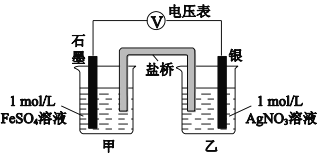
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是___________。
② b中电压表指针逆向偏移后,银为_________极(填“正”或“负”)。
③ 由实验得出Ag+和Fe2+反应的离子方程式是___________。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
序号 | 操作 | 现象 |
实验Ⅲ | 将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中 | 银镜消失 |
实验Ⅳ | 将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中 | 银镜减少,未消失 |
实验Ⅴ | 将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中 | 银镜消失 |
① 实验Ⅲ___________(填“能”或“不能”)证明Fe3+氧化了Ag,理由是_____________。
② 用化学反应原理解释实验Ⅳ与Ⅴ的现象有所不同的原因:_____________。
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 位于第2周期,原子核外有3对成对电子、两个未成对电子 |
d | 位于周期表中第1纵列 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)c属于_____________区的元素。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为______________(用元素符号表示)。
(3)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的中心原子的轨道杂化类型为_____________,A的空间构型为____________________;
(4)d 的某氯化物晶体结构如图,每个阴离子周围等距离且最近的阴离子数为________;在e2+离子的水溶液中逐滴滴加b的氢化物水溶液至过量,可观察到的现象为_____________。