题目内容
【题目】KIO3是我国规定的食盐补碘剂,利用“KClO3氧化法”可制备KIO3,流程如下:
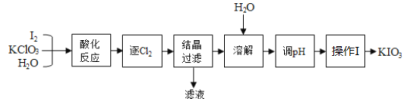
已知:“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。
(1)KIO3所含的化学键有______________________。
(2)逐出的Cl2可用_________________检验;“滤液”中的溶质主要是____________;“调pH”中所用的试剂是_________________。
(3)已知KIO3在水中的溶解度随温度升高而增大,则操作I包含的操作应该是_______、_______、过滤。
(4)为测定“加碘食盐”中碘元素含量:①称取50.000g食盐,配成250mL溶液;②量取25.00mL溶液于锥形瓶中,加入足量KI,并用少量稀硫酸酸化,使KIO3与KI反应完全;③以淀粉为指示剂,用2.0×10-4mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液体积为30.00mL。已知:KIO3+KI+H2SO4→K2SO4+I2+H2O(未配平),2Na2S2O3+I2→Na2S4O6+2NaI。测定过程中,所需仪器在使用前必须检查是否漏液的有________________。
(5)判断滴定终点的依据是________________________________。
(6)配平:KIO3+KI+H2SO4→K2SO4+I2+H2O ____________
(7)该食盐中碘元素的含量是_________mg/kg。
【答案】离子键和共价键 湿润的KI淀粉试纸检验 KCl KOH溶液 蒸发浓缩 冷却结晶 容量瓶、滴定管 溶液由蓝色变成无色,且30秒内无变化 KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O 25.4
【解析】
碘和氯酸钾溶于水后酸化,发生反应生成KH(IO3)2、Cl2和KCl,逐出氯气后,采取结晶的方法得到KH(IO3)2晶体和滤液KCl,然后把KH(IO3)2加水溶解,加入氢氧化钾溶液,调节溶液的pH,使KH(IO3)2转变为KIO3溶液,然后进行蒸发浓缩 、冷却结晶,过滤,得到KIO3固体;据以上分析并结合题目中问题进行分析。
碘和氯酸钾溶于水后酸化,发生反应生成KH(IO3)2、Cl2和KCl,逐出氯气后,采取结晶的方法得到KH(IO3)2晶体和滤液KCl,然后把KH(IO3)2加水溶解,加入氢氧化钾溶液,调节溶液的pH,使KH(IO3)2转变为KIO3溶液,然后进行蒸发浓缩 、冷却结晶,过滤,得到KIO3固体;
(1)KIO3属于离子化合物,一定含有离子键;除此以外,碘原子和氧原子间存在共价键;
综上所述,本题答案是:离子键和共价键。
(2)Cl2具有氧化性,可以把碘离子氧化为碘单质,碘可使淀粉变蓝,因此可以用湿润的KI淀粉试纸检验氯气;根据流程可知,“酸化反应”所得产物有KH(IO3)2、Cl2和KCl,所以“滤液”中的溶质主要是KCl;结晶得到KH(IO3)2的溶液显酸性,用KOH溶液来“调pH”,使KH(IO3)2与KOH反应生成碘酸钾溶液;
综上所述,本题答案是:湿润的KI淀粉试纸检验;KCl ;KOH溶液。
(3)已知KIO3在水中的溶解度随温度升高而增大,则操作I包含的操作应该是蒸发浓缩 、冷却结晶 、过滤。
综上所述,本题答案是:蒸发浓缩 、冷却结晶。
(4) 测定“加碘食盐”中碘元素含量操作中使用了容量瓶和滴定管,使用前必须检查是否漏水,因此,本题正确答案是: 容量瓶、滴定管;
(5)碘与淀粉相遇,溶液显蓝色,当滴加最后一滴Na2S2O3溶液后,溶液由蓝色变成无色,且30秒内无变化,达到滴定终点;
综上所述,本题答案是:溶液由蓝色变成无色,且30秒内无变化。
(6) KIO3→I2,碘元素由+5降低到0价;KI→I2,碘元素由-1价升高到0价;根据氧化还原反应化合价升降总数相等规律可知,KIO3的系数为1,KI的系数为5,再根据原子守恒配平其他物质系数,具体为:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
综上所述,本题答案是:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;
(7)KIO3与KI反应完全的离子方程式为IO3-+5I-+6H+= 3I2+3H2O;反应的关系式为IO3-~ 3I2~6 S2O32-,n(Na2S2O3)=2.0×10-4mol/L×30.00mL×10-3=6×10-6mol;由关系式可以知道n(KIO3)= 1×10-6mol;250mL溶液中含有n(KIO3)= 1×10-6mol×(250mL/25mL)= 1×10-5mol,n(I)= n(KIO3) = 1×10-5mol,质量为m(I)= 1×10-5mol×127g/mol=1.27×10-3g=1.27 mg;根据50.000g食盐中含有碘元素的含质量为1.27mg;则1kg食盐中含有碘元素的含质量为1.27 mg×1000g/kg÷50g=25.4 mg/kg。
综上所述,本题答案是:25.4。

 名校课堂系列答案
名校课堂系列答案【题目】将高温水蒸气通到硫氰化钾的表面,会发生反应:4KSCN + 9H2O(g) → K2CO3 + K2S + 3CO2 + 3H2S + 4NH3完成下列填空:
(1)上述反应所涉及的各元素中,离子半径最大的是_____________(填离子符号);属于第二周期元素的非金属性由强到弱的顺序为_________________。
(2)上述反应所涉及的各物质中,属于非电解质的是_________________。
(3)写出CO2的电子式____________,其熔沸点低的原因是___________________________。
(4)已知物质的量浓度均为0.10 mol/L的K2CO3和K2S溶液pH如下:
溶液 | K2CO3 | K2S |
pH | 11.6 | 12.5 |
K2CO3水溶液呈碱性的原因是______________________________(用离子方程式表示)。从表中数据可知,K2CO3溶液中c(CO32-)_______K2S溶液中的c(S2—)(填“>”“<”或“=”)。
(5)K2S接触潮湿银器表面,会出现黑色斑点(Ag2S),其原理如下:____K2S + ____Ag + _____O2 + _____H2O → _____Ag2S + _____KOH
①配平上述反应________________。
②每消耗标准状况下224 mL O2,转移电子数目为_____________。
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。