题目内容
【题目】请应用化学反应原理的相关知识解决下列问题
(1)已知NaCl的溶解热为3.8kJ·mol-1(吸热)
Na(s)-e-====Na+(aq) △H=-240 kJ/mol
![]() Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
Cl2(g)+e-====Cl-(aq) △H=-167 kJ/mol
写出钠在氯气中燃烧的热化学方程式_______________________。
(2)一定条件下,在2L恒容密闭容器中充入1.5 mol CO2和3molH2发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H3O(g)
CH3OH(g) +H3O(g)
下图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500K的条件下,该反应l0min达到平衡;
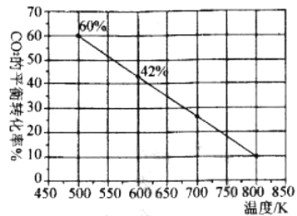
①该反应是__________ (填“吸热”或“放热”)反应。
②在0~10min时段反应速率v(H2)为__________。
③若改充入2 mol CO2和3molH2,图中的曲线会__________(填“上移”或“下移”)。
(3)根据下表数据回答问题:
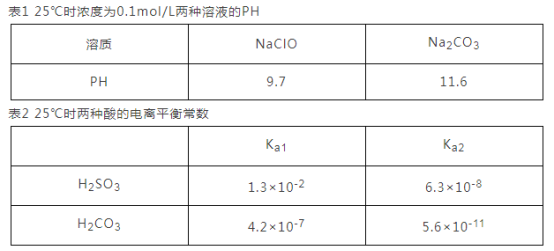
①根据表1能不能判断出H2CO3与HClO酸性强弱? _________(填“能”或“不能”)。
②0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为___________________________。
③H2SO3溶液和 NaHCO3溶液反应的离子方程式为________________________________。
(4)已知:t℃时,Ksp(AgCl)=1.5×10-10、Ksp (Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t℃时,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为_____________________________________________。
【答案】Na(s)+![]() Cl2(g) = NaCl(s) △H = -410.8 kJ/mol 放热 0.135 mol·L-1·min-1 下移 不能 c(Na+)
Cl2(g) = NaCl(s) △H = -410.8 kJ/mol 放热 0.135 mol·L-1·min-1 下移 不能 c(Na+)![]() c(SO32-)
c(SO32-)![]() c(OH-)
c(OH-)![]() c(HSO3-)
c(HSO3-)![]() c(H+) H2SO3+ HCO3- = HSO3-+H2O+ CO2↑ 先生成白色沉淀,后来变成砖红色
c(H+) H2SO3+ HCO3- = HSO3-+H2O+ CO2↑ 先生成白色沉淀,后来变成砖红色
【解析】
(1)根据已知焓变的反应推导所求反应,再根据盖斯定律计算所求反应的焓变;
(2)①根据图象分析,随着温度升高,CO2平衡转化率降低,表明温度升高不利于反应正向进行;
②温度为500K时,CO2的平衡转化率为60%,根据反应方程式计算各组分的平衡浓度,据此计算氢气的化学反应速率;
③改充入2 mol CO2 和3 mol H2,相当于增加了CO2的比例,可使H2的转化率上升,自身转化率下降;
(3)①根据NaClO和Na2CO3的pH值只能比较HClO和HCO3-的酸性强弱;
②0.1mol/L Na2SO3溶液中,SO32-水解使溶液显碱性,根据溶液中存在的化学平衡比较溶液中各离子的相对浓度大小;
③根据电离常数分析,H2SO3的酸性比H2CO3的酸性强,因此SO2通入NaHCO3溶液中生成CO2,据此写出反应的离子方程式;
(4)根据溶度积公式,分别计算出向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液生成AgCl和Ag2CrO4所需要的银离子的浓度,浓度越小越先沉淀,进而再判断过量以后的实验现象。
(1)已知:①NaCl的溶解热为3.8 kJ/mol(吸热),NaCl(s)═Na+(aq)+Cl(aq) △H1 = +3.8 kJ/mol,
②Na(s)e=Na+(aq) △H2 = 240 kJ/mol,
③![]() Cl2(g)+e═Cl(aq) △H3 = 167 kJ/mol,
Cl2(g)+e═Cl(aq) △H3 = 167 kJ/mol,
Na在氯气中燃烧的方程式为Na(s)+![]() Cl2(g) = NaCl(s),该反应可由②+③①得到,根据盖斯定律,该反应的焓变△H=△H2+△H3△H1 = 410.8 kJ/mol,
Cl2(g) = NaCl(s),该反应可由②+③①得到,根据盖斯定律,该反应的焓变△H=△H2+△H3△H1 = 410.8 kJ/mol,
故答案为:Na(s)+![]() Cl2(g) = NaCl(s) △H = -410.8 kJ/mol;
Cl2(g) = NaCl(s) △H = -410.8 kJ/mol;
(2)①随着温度升高,CO2平衡转化率降低,表明温度升高不利于反应正向进行,所以反应为放热反应,
故答案为:放热;
②温度为500 K时,CO2的平衡转化率为60%,CO2转化的浓度分别为![]() c(CO2) =
c(CO2) = ![]() = 0.45 mol/L,根据化学计量数之比等于速率之比,可知H2转化的浓度
= 0.45 mol/L,根据化学计量数之比等于速率之比,可知H2转化的浓度![]() c(H2) = 3
c(H2) = 3![]() c(CO2) = 1.35 mol/L,所以其化学反应速率
c(CO2) = 1.35 mol/L,所以其化学反应速率![]() (H2) =
(H2) =![]() =
= ![]() = 0.135 mol·L-1·min-1
= 0.135 mol·L-1·min-1
故答案为:0.135 mol·L-1·min-1;
③改充入2 mol CO2 和3 mol H2,相当于增加了CO2的比例,可使H2的转化率上升,自身转化率下降;所以图中的曲线会下移,
故答案为:下移;
(3)①因H2CO3为二元弱酸,第一步电离得到的HCO3-,第二步电离生成CO32-,所以根据NaClO和Na2CO3的pH值只能比较HClO和HCO3-的酸性强弱,不能比较HClO和H2CO3的酸性强弱,
故答案为:不能;
②0.1 mol/L Na2SO3溶液中,SO32水解使溶液显碱性,溶液中存在SO32+H2OHSO3+OH,HSO3+H2OH2SO3+OH,H2OH++OH,综合考虑溶液中离子浓度大小顺序为:c(Na+)![]() c(SO32-)
c(SO32-)![]() c(OH-)
c(OH-)![]() c(HSO3-)
c(HSO3-)![]() c(H+),
c(H+),
故答案为:c(Na+)![]() c(SO32-)
c(SO32-)![]() c(OH-)
c(OH-)![]() c(HSO3-)
c(HSO3-)![]() c(H+);
c(H+);
③根据电离常数及强酸制弱酸的原理分析,H2SO3的酸性比H2CO3的酸性强,因此SO2通入NaHCO3溶液中生成CO2,所以SO2通入NaHCO3溶液中发生的主要反应的离子方程式为:H2SO3+ HCO3- = HSO3-+H2O+ CO2↑,
故答案为:H2SO3+ HCO3- = HSO3-+H2O+ CO2↑;
(5)开始形成AgCl时,需要的Ag+的浓度c(Ag+) = ![]() =
= ![]() = 1.5×10-9,同理可得开始形成Ag2CrO4时,需要的Ag+的浓度c(Ag+) =
= 1.5×10-9,同理可得开始形成Ag2CrO4时,需要的Ag+的浓度c(Ag+) = ![]()
![]() 4.5×10-6,显然先沉淀AgCl,再沉淀Ag2CrO4,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为:先生成白色沉淀,后来变成砖红色,
4.5×10-6,显然先沉淀AgCl,再沉淀Ag2CrO4,向Cl-和CrO42-浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为:先生成白色沉淀,后来变成砖红色,
故答案为:先生成白色沉淀,后来变成砖红色。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
