题目内容
短周期元素aA2+、bB+、cC3-、dD-都具有相同电子层结构,则下列叙述正确的是( )
| A.原子半径A>B>D>C | B.原子序数D>C>B>A |
| C.离子半径C>D>B>A | D.单质还原性A>B>D>C |
解析试题分析:A选项,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A,C>D,电子层越大原子半径越大,所以原子半径B>A>C>D,故A错误;B选项,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,故B错误;C选项,电子层结构相同,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径C3->D->B+>A2+,故C正确;D选项,A、B处于同一周期,A、B形成阳离子,则A、B为金属,原子序数A>B,单质还原性B>A,C、D处于同一周期,C、D形成阴离子,则C、D为非金属,原子序数D>C,单质氧化性D>C,故D错误。
考点:原子结构与元素周期率的关系

短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是( )
| A.原子半径的大小顺序: r(Y)>r(Z)>r(W) |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
下列关于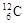 、
、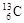 、
、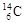 的说法正确的是
的说法正确的是
| A.它们的物理性质相似 | B.它们是碳元素的三种核素 |
| C.它们是碳元素的三种单质 | D.它们是碳元素的同素异形体 |
下列各组中互为同位素的是( )
| A.O2和O3 | B.1H 和2H | C.H2O和H2O2 | D.O2–和O |
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是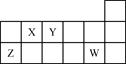
| A.原子半径的大小顺序:rZ>rY>rX |
| B.氢化物的稳定性强弱顺序:XH4>YH3>HW |
| C.Y的氢化物与W的氢化物化合所得产物中只含有共价键 |
| D.X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| | X | Y | Z | M | R | Q |
| 原子半径/nm | | | 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合价 | | -4,+4 | | -2 | -1,+7 | +3 |
| 其它 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 | | | |
下列说法正确的是
A.X与M形成的化合物中含有离子键
B.Z、M、Q三种元素的简单离子的半径:M>Z>Q
C.Y与R形成的化合物中R呈正价,说明Y的非金属性比R强
D.在元素周期表中,Q位于金属与非金属的交界处,可以作半导体材料
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
四种短周期元素在周期表中的相对位置如右表所示,下列说法错误的是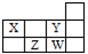
| A.X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B.Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C.X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D.W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |