题目内容
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
C
解析试题分析:Z原子最外层电子数是X原子内层电子数的2倍,所以Z最外层电子数为4,则Y原子最外层电子数为2,Y、Z在同一个周期且X、Y、Z原子序数依次增大,所以X为氮元素,Y为镁元素,Z为硅元素。A、离子半径N>Mg,错误;B、稳定性SiH4<NH3,错误;C、MgO中存在离子键,正确;D、SiO2不溶于水,错误。
考点:考查了元素的推断和基本性质。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列判断正确的是 ( )
| A.元素周期表中查得的相对原子质量为同位素的相对原子质量 |
| B.化学键的变化一定会引起化学反应的变化 |
| C.只含有共价键的物质一定是共价化合物 |
| D.全部由极性键构成的分子不一定是极性分子 |
短周期元素aA2+、bB+、cC3-、dD-都具有相同电子层结构,则下列叙述正确的是( )
| A.原子半径A>B>D>C | B.原子序数D>C>B>A |
| C.离子半径C>D>B>A | D.单质还原性A>B>D>C |
短周期元素X、Y、Z的原子序数依次递增,其原予的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是( )
| A.X的氢化物溶于水生成弱酸 |
| B.Y与X可生成Y3X2型化合物 |
| C.Z的氢化物的水溶液在空气中存放不易变质 |
| D.Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
下列对非金属元素(除稀有气体外)的相关判断正确的是
①非金属元素都是主族元素
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
| A.②⑤ | B.①③ | C.①⑤ | D.③④ |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是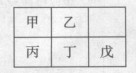
| A.原子半径:丙<丁<戊 |
| B.元素金属性:甲>丙 |
| C.氢氧化物碱性:丙<丁<戊 |
| D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是 ( )
| A.第一电离能:④>③>②>① | B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>③=②>① |
根据电子排布的特点,铜元素在周期表属于
| A.s区 | B.p区 | C.d 区 | D.ds区 |