题目内容
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中不正确的是
A.原子序数A>B>C B.离子半径A2->C->B2+
C.原子半径C>B>A D.最外层电子数C>A>B
C
解析试题分析:A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,可知A为氧,C为氟。由于B2+与C-具有相同的电子层结构,则B为镁。故C.错误,正确顺序为原子半径B>A>C。
考点:考查根据元素周期律知识推断元素,并判断原子,离子的半径大小。

练习册系列答案
相关题目
元素周期表中铋元素的数据见图,下列说法正确的是( )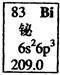
| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层(能级)有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |
自然界中氧元素有三种同位素16O、17O、18O,氧元素的相对原子质量为15.9994,
由此可知16O的相对原子质量为( )
| A.>16 | B.<16 | C.=16 | D.不能确定 |
短周期元素aA2+、bB+、cC3-、dD-都具有相同电子层结构,则下列叙述正确的是( )
| A.原子半径A>B>D>C | B.原子序数D>C>B>A |
| C.离子半径C>D>B>A | D.单质还原性A>B>D>C |
下列变化中,可逆性最不明显的是
| A.NH3+H2O→NH3·H2O | B.Br2+H2→2HBr |
| C.H2+I2→2HI | D.HClO→H++ClO- |
短周期元素X、Y、Z的原子序数依次递增,其原予的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是( )
| A.X的氢化物溶于水生成弱酸 |
| B.Y与X可生成Y3X2型化合物 |
| C.Z的氢化物的水溶液在空气中存放不易变质 |
| D.Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是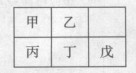
| A.原子半径:丙<丁<戊 |
| B.元素金属性:甲>丙 |
| C.氢氧化物碱性:丙<丁<戊 |
| D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是
| A.原子半径:Z>W>R |
| B.对应的氢化物的热稳定性:R>W |
| C.W与X、W与Z形成的化合物的化学键类型完全相同 |
| D.Y的最高价氧化物对应的水化物是弱酸 |