题目内容
【题目】一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
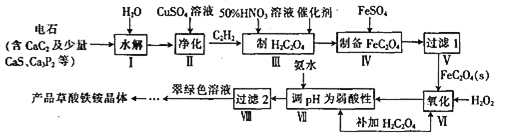
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________,硝酸的浓度及反应温度都不宜过高,是因为____________.
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________.
(6)步骤VIII由滤液制得产品的操作为____________、____________、过滤、洗涤、干燥。
【答案】![]() 4:1
4:1 ![]() 升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化 取最后一次洗涤液少许滴入盐酸酸化的
升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化 取最后一次洗涤液少许滴入盐酸酸化的![]() 溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净 草酸过量,使溶液中
溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净 草酸过量,使溶液中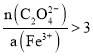 ,从而得到更多的产品 加热(蒸发)浓缩 冷却结晶
,从而得到更多的产品 加热(蒸发)浓缩 冷却结晶
【解析】
(1)CaC2中碳碳共用三对电子,因此可以书写电子式。
(2)根据氧化还原反应化合价升降守恒分析得出。
(3)根据反应信息和氧化还原反应得到化学方程式,由于浓度越大,温度越高,硝酸氧化性越强,易将草酸氧化。
(4)沉淀表面有硫酸根杂质,检验其是否洗涤干净,主要是验证最后一次洗液中是否有硫酸根。
(5)步骤Ⅵ、VII补加草酸,增加草酸浓度,有利于平衡向生成草酸铁铵方向移动得到更多产品。
(6)步骤VIII由滤液制得产品,从溶液到晶体遵循一般采用蒸发浓缩、冷却结晶等。
(1)CaC2的电子式为![]() ,故答案为:
,故答案为:![]() 。
。
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,,PH3中P化合价升高8个价态,作还原剂,CuSO4中Cu化合价降低2个,作氧化剂,根据化合价升降守恒,因此该反应中氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1。
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为3C2H2+8HNO3 ![]() H2C2O4+4 H2O+8NO,硝酸具有强氧化性,浓度越大,温度越高,氧化性越强,易将草酸氧化,因此硝酸的浓度及反应温度都不宜过高,是因为升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化,故答案为:3C2H2+8HNO3
H2C2O4+4 H2O+8NO,硝酸具有强氧化性,浓度越大,温度越高,氧化性越强,易将草酸氧化,因此硝酸的浓度及反应温度都不宜过高,是因为升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化,故答案为:3C2H2+8HNO3 ![]() H2C2O4+4 H2O+8NO;升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化。
H2C2O4+4 H2O+8NO;升高温度、增大硝酸浓度,会使硝酸的氧化性增强,会导致草酸进一步被氧化。
(4)“过滤1”需对沉淀进行洗涤,沉淀表面有硫酸根杂质,检验其是否洗涤干净,主要是验证最后一次洗液中是否有硫酸根,其依据是取最后一次洗涤液少许滴入盐酸酸化的BaCl2溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净,故答案为:取最后一次洗涤液少许滴入盐酸酸化的BaCl2溶液中,若无白色沉淀生成,说明已洗涤干净;若产生白色沉淀,说明未洗涤干净。
(5)步骤Ⅵ、VII补加草酸,增加草酸浓度,有利于平衡向生成草酸铁铵方向移动,因此目的是草酸过量,使溶液中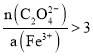 ,从而得到更多的产品,故答案为:草酸过量,使溶液中
,从而得到更多的产品,故答案为:草酸过量,使溶液中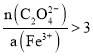 ,从而得到更多的产品。
,从而得到更多的产品。
(6)步骤VIII由滤液制得产品,溶液到晶体一般的操作为加热(蒸发)浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:加热(蒸发)浓缩、冷却结晶。

【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = +41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
则CO2催化氢化合成甲醇的热化学方程式:______________________。
(2)工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
CH3OH(g)。判断反应达到平衡状态的依据是(填字母序号)________.
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
(3)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度℃ | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
①该反应的化学平衡常数表达式为K=_____。
②由表中数据判断该反应的△H_____0(填“>”、“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为___________℃。
(4)要提高CO的转化率,可以采取的措施是(填字母序号)__________________.
a.增加CO的浓度 b.加入催化剂 c.升温 d.加入H2 e.加入惰性气体 f.分离出甲醇
(5)在一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1体系中CO2的平衡转化率(![]() )与L和X的关系如图所示,L和X分别表示温度或压强。
)与L和X的关系如图所示,L和X分别表示温度或压强。

①X表示的物理量是_____。
②判断L1与L2的大小关系:L1_____L2(填“<”,“=”或“>”),并简述理由:____________________。