题目内容
【题目】已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B,C、D与E分别位于同一周期。A原子L层上有2对成对电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)请写出F离子的电子排布式_________。
(2)写出X的化学式________,X的化学名称为______。
(3)写出X涉及化工生产中的一个化学方程式:__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:____________。
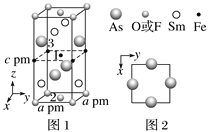
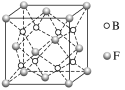
(5)F与B可形成离子化合物,其晶胞结构如图所示。F与B形成的离子化合物的化学式为__________;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是________(只要求列出算式)。
【答案】1s22s22p63s23p6 Na3AlF6 六氟合铝酸钠 2Al2O3(熔融) 4Al+3O2↑ Al2O3为离子晶体(或离子化合物),而AlCl3为分子晶体(或共价化合物) CaF2(或FB2) V=
4Al+3O2↑ Al2O3为离子晶体(或离子化合物),而AlCl3为分子晶体(或共价化合物) CaF2(或FB2) V=![]()
【解析】
A原子L层上有2对成对电子,则A是O元素,A和B同周期,且B的原子序数大于A,B能形成离子,所以B是F元素;FA是离子化合物,F应该是+2价,属于第二主族,且F原子序数增大,但属于前20号元素,所以F是Ca元素;C、D与E分别位于同一周期,且原子序数依次增大,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体,B显-2价,C和D的化合价都为正整数,根据原子个数知,C是+1价,D是+3价,且原子序数大于10,所以C是Na元素,D是Al元素,E是Cl元素.
(1)根据核外电子排布式的书写规则书写;
(2)先确定元素,然后写出化学式及名称;
(3)铝的冶炼工业中用冰晶石来降低熔点;
(4)氧化铝是离子晶体,氯化铝是分子晶体,其熔点不同;
(5)利用均摊法确定化学式,晶胞的质量与其密度之比为体积。
A原子L层上有2对成对电子,则A是O元素,A和B同周期,且B的原子序数大于A,B能形成离子,所以B是F元素;FA是离子化合物,F应该是+2价,属于第二主族,且F原子序数增大,但属于前20号元素,所以F是Ca元素;C、D与E分别位于同一周期,且原子序数依次增大,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体,B显-2价,C和D的化合价都为正整数,根据原子个数知,C是+1价,D是+3价,且原子序数大于10,所以C是Na元素,D是Al元素,E是Cl元素.
(1)F是Ca元素,钙原子失去最外层一个电子变成钙离子,钙离子的核外电子排布式为1s22s22p63s23p6;
故答案为:1s22s22p63s23p6;
(2)通过以上分析知,C是Na元素,D是Al元素,B是F元素,所以其化学式为Na3AlF6,名称是六氟合铝酸钠;
故答案为:Na3AlF6;六氟合铝酸钠;
(3)铝的冶炼工业中用冰晶石来降低熔点,化学方程式为: ;
;
故答案为: ;
;
(4)氯化铝为分子晶体,氧化铝为离子晶体,用氧化铝冶炼铝消耗能量大,
故答案为:Al2O3为离子晶体(或离子化合物),而AlCl3为分子晶体(或共价化合物);
(5)该分别中氟离子个数=8,钙离子个数![]() ,钙离子和氟离子个数比
,钙离子和氟离子个数比![]() ,所以其化学式为CaF2,该晶胞中含有8个氟离子,4个钙离子,其质量为
,所以其化学式为CaF2,该晶胞中含有8个氟离子,4个钙离子,其质量为
![]() ,密度为ρ,所以其体积V
,密度为ρ,所以其体积V![]() ;
;
故答案为:CaF2;V=![]()

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案