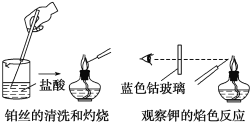
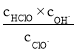题目内容
【题目】工业上研究高效处理煤燃烧释放出来的SO2,有利于减小环境污染。在T℃时,利用CO处理SO2的反应为:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;
2CO2(g)+S(l) △H=akJ/mol;
(1)已知T℃时:C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol
C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则T℃时,a=___。
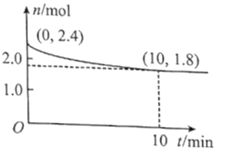
(2)在T℃下,将1.4molCO和1molSO2通入2L恒容容器中发生上述反应,反应体系气体总物质的量随时间变化如图;在0~10min,反应的平均速率v(CO)=___,SO2的平衡转化率![]() (SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(SO2)=___%;在T℃时该反应的平衡常数Kc=___L/mol。
(3)实验测得:v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() ,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),
,k正、k逆为只受温度影响的速率常数。若将(2)中容器内的温度升高(假设各物质的状态不发生变化),![]() 的值将___(填“增大”、“减小”或“不变”)。
的值将___(填“增大”、“减小”或“不变”)。
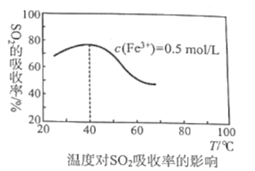
(4)某科研团队研究用Fe2(SO4)3(aq)处理SO2:Fe3+溶液吸收SO2发生的离子反应方程式为___;其他外界条件不变下,在相同时间内温度对SO2吸收率的影响结果如图,在40℃前,SO2的吸收率随温度变化的可能原因是___;在40℃后,SO2的吸收率发生的变化是温度升高该反应逆向移动的结果,导致反应逆向移动的原因:一是该反应为放热反应,二是___。
【答案】-269 0.06mol/(Lmin) 60 180 减小 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 温度越高,反应越快 Fe3+水解程度增大导致c(Fe3+)减小,c(H+)增大;SO2溶解性减小,导致c(SO2)减小
【解析】
(1)应用盖斯定律即可求算a;
(2)结合已知条件及图示信息,可知图中纵坐标为混合气体的物质的量,则平衡是混合气体的物质的量一共为1.8mol,据此用三段式计算即可;
(3)要判断(2)中容器内的温度升高后![]() 的值将如何变化,可把升温后正、逆反应速率的变化通过测得的2个速率方程——v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆
的值将如何变化,可把升温后正、逆反应速率的变化通过测得的2个速率方程——v正=v(CO)消耗=k正c(CO)c(SO2),v逆=v(CO2)消耗=k逆![]() 变形,找出
变形,找出![]() 的变化情况;
的变化情况;
(4)Fe3+溶液吸收SO2发生氧化还原反应,从图知,在相同时间内温度对SO2吸收率的影响是40℃前随温度升高而增大,则可能原因从温度对反应速率的影响回答;在40℃后,SO2的吸收率有所下降,则考虑温度升高对铁离子和二氧化硫间接带来的浓度影响;
(1)已知T℃时:反应①C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol,反应②S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol,反应③C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol,反应②S(l)+O2(g)=SO2(g) △H2=-290.0kJ/mol,反应③C(s)+O2(g)=CO2(g) △H3=-390.0kJ/mol
则,按盖斯定律,2×③-2×①-②即得2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=akJ/mol;则△H =2×△H3-2×△H1-△H2=2×(-390.0kJ/mol)-2×(-110.5kJ/mol)-(-290.0 kJ/mol)=-269 kJ/mol ,即T℃时,a=-269;
2CO2(g)+S(l) △H=akJ/mol;则△H =2×△H3-2×△H1-△H2=2×(-390.0kJ/mol)-2×(-110.5kJ/mol)-(-290.0 kJ/mol)=-269 kJ/mol ,即T℃时,a=-269;
答案为:-269;
(2) ,则x=0.6 mol,则
,则x=0.6 mol,则 ;
;![]() =60%;
=60%;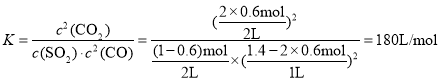 ;
;
答案为:0.06mol/(Lmin); 60; 180;
(3)T℃时容器(2)内发生的反应2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H=-269kJ/mol,若升温,则正、逆反应速率均增大,但是吸热方向的逆反应速率增加得更快,则v正<v逆,k正c(CO)c(SO2)<k逆
2CO2(g)+S(l) △H=-269kJ/mol,若升温,则正、逆反应速率均增大,但是吸热方向的逆反应速率增加得更快,则v正<v逆,k正c(CO)c(SO2)<k逆![]() ,故
,故 ,
,
当温度升高时,KC变小,则![]() 减小;
减小;
答案为:减小;
(4)Fe3+与SO2发生氧化还原反应得到Fe3和SO42-,则离子方程式为:2Fe3++SO2+2H/span>2O=2Fe2++SO42-+4H+;从图知,40℃前随温度升高,相同时间内SO2吸收率随着增大,从温度对反应的影响可以推知:温度越高,反应越快,相同时间内SO2吸收率就高;温度上升超过40℃,SO2的吸收率有所下降,则温度对反应速率的直接影响不再是主要原因,因而要找间接影响,由于Fe3+会水解、二氧化硫的溶解性会随温度升高而减小,这些都可能影响到相同时间内SO2吸收率,故可能原因为:温度上升超过40℃,Fe3+水解程度增大导致c(Fe3+)减小,c(H+)增大;SO2溶解性减小,导致c(SO2)减小;
答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;温度越高,反应越快; Fe3+水解程度增大导致c(Fe3+)减小,c(H+)增大;SO2溶解性减小,导致c(SO2)减小。

【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定