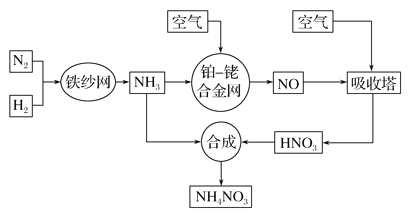
题目内容
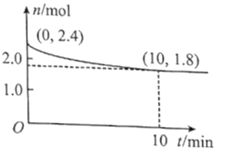
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol·L-1的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如图所示。下列说法正确的是( )
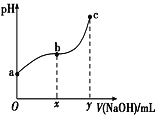
A.a点溶液中存在:N(HClO)+N(Cl-)+N(ClO-)=0.2NA(N表示粒子数),若想增加a点溶液的漂白能力可向溶液中加入碳酸钙固体
B.若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
C.b~c段,随NaOH溶液的滴入,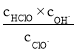 逐渐增大
逐渐增大
D.若y=200,则c点对应溶液中:c(HClO)+c(H+)=c(OH-)-2c(Cl-)
【答案】D
【解析】
整个过程先后发生的反应为Cl2+H2O![]() HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O.
HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O.
A.a点溶液中存在末反应的氯分子:N(HClO)+N(Cl-)+N(ClO-)<0.2NA(N表示粒子数),故A错误;
B.若a点pH=4,c(H+)=10-4mol·L-1,溶液呈酸性,根据方程式知c(HClO)=c(Cl-)-c(ClO-),c(Cl-)=m c(ClO-),则c(HClO)=(m-1)c(ClO-),Ka(HClO)=![]() ,则Ka(HClO)=
,则Ka(HClO)=![]() ,故B错误;
,故B错误;
C.b~c段,Cl2恰好与NaOH溶液生成NaCl、NaClO,随NaOH溶液的滴入,NaOH抑制NaClO水解:ClO-+H2O![]() HClO+OH-,c(HClO)减小,c(ClO-)增大,但水解常数只受温度影响,温度不变,水解常数
HClO+OH-,c(HClO)减小,c(ClO-)增大,但水解常数只受温度影响,温度不变,水解常数![]() 不变,故C错误;
不变,故C错误;
D.若y=200,c点对应溶液中存在0.1molNaCl、0.1molNaClO、0.2molNaOH,根据电荷守恒得:c(H+)+c(Na+)=c(Cl-)+c(ClO-)+c(OH-)①,氯元素守恒得:c(Cl-)=c(ClO-)+c(HClO) ②,2c(Cl-)+2c(ClO-)+2c(HClO)=c(Na+)③,由①+③+②得:c(HClO)+c(H+)=c(OH-)-2c(Cl-),故D正确;
故选D。

【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
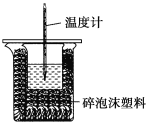
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌