题目内容
【题目】可用来鉴别己烯、四氯化碳、甲苯的方法是( )
A.酸性高锰酸钾
B.溴水
C.液溴
D.NaOH
【答案】AB
【解析】解:A.四氯化碳、甲苯和己烯分别与酸性高锰酸钾混合的现象分别为分层后有机层在下层、分层后有机层在上层、紫色褪去,现象不同,可鉴别,故A选; B.四氯化碳、甲苯和己烯与溴水混合的现象分别为分层后有机色层在下层、分层后有机色层在上层、溴水褪色,现象不同,可鉴别,故B选;
C.四氯化碳、甲苯均与液溴不分层,现象相同,不能鉴别,故C不选;
D.均不与NaOH溶液反应,且苯和己烯与NaOH溶液混合的现象相同,不能鉴别,故D不选;
故选AB.

【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
主族 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)在⑤~⑨元素中,原子半径最小的是 , 其离子的原子结构示意图为 , 离子半径最大的是 .
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 .
(3)写出⑤和⑦的最高价氧化物对应水化物反应的离子方程式;
(4)按要求写出下列两种物质的电子式:②的氢化物;⑤的一种氧化物呈淡黄色,其含有的化学键类型有 , 电子式为 .
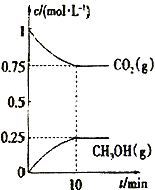
【题目】参考下列图表和有关要求回答问题:
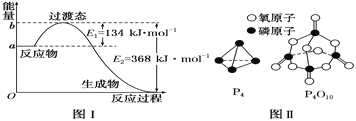
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是________(填“增大”“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:_________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:____________________________________
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O===O | P===O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1 mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=________ kJ·mol-1