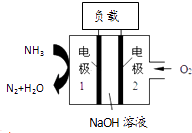
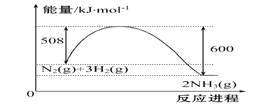
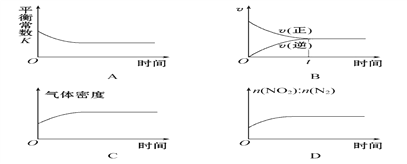
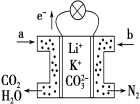
��Ŀ����
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���д���пհף���������˵������Ԫ�ط��š���ѧʽ�Ȼ�ѧ���
���� | IA | ��A | IIIA | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� |
��1���ڢݡ���Ԫ���У�ԭ�Ӱ뾶��С���� �� �����ӵ�ԭ�ӽṹʾ��ͼΪ �� ���Ӱ뾶������ ��
��2����ЩԪ�ص�����������Ӧ��ˮ�����У�������ǿ���� �� ������ǿ���� ��
��3��д���ݺ͢ߵ�����������Ӧˮ���ﷴӦ�����ӷ���ʽ��
��4����Ҫ��д�������������ʵĵ���ʽ���ڵ��⻯�����ݵ�һ��������ʵ���ɫ���京�еĻ�ѧ�������� �� ����ʽΪ ��
���𰸡�
��1��Cl��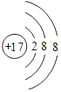 ��S 2��
��S 2��
��2��HClO4��KOH
��3��OH��+Al��OH��3=AlO2��+2H2O
��4��![]() �����Ӽ����ۼ���
�����Ӽ����ۼ���![]()
���������⣺����Ԫ�������ڱ��е�λ��֪���١���ֱ���H��N��O��F��Na��Mg��Al��S��Cl��KԪ�أ���1��ͬһ����Ԫ�أ�ԭ�Ӱ뾶����ԭ�������������С����ݡ���Ԫ��λ��ͬһ���ڣ�ԭ�Ӱ뾶��С����Cl����ԭ�ӵõ������������ӣ����������Ӻ�����18�����ӡ�������������17��������ԭ�ӽṹʾ��ͼΪ 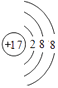 �����ӵ��Ӳ���Խ�������Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���������Ӱ뾶������S 2�� �� ���Դ��ǣ�Cl��
�����ӵ��Ӳ���Խ�������Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С���������Ӱ뾶������S 2�� �� ���Դ��ǣ�Cl�� 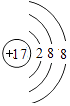 ��S 2������2��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ����O��FԪ�س��⣬�����O��FԪ����ǽ�������ǿ��Ԫ����ClԪ�أ���������ǿ����HClO4��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ����������ǿ����KԪ�أ�������������ˮ���������ǿ����KOH��
��S 2������2��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ����O��FԪ�س��⣬�����O��FԪ����ǽ�������ǿ��Ԫ����ClԪ�أ���������ǿ����HClO4��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ����������ǿ����KԪ�أ�������������ˮ���������ǿ����KOH��
���Դ��ǣ�HClO4��KOH����3���ݺ͢ߵ�����������Ӧˮ����ֱ���NaOH��Al��OH��3 �� ���߷�Ӧ����NaAlO2��ˮ�����ӷ���ʽΪOH��+Al��OH��3=AlO2��+2H2O��
���Դ��ǣ�OH��+Al��OH��3=AlO2��+2H2O����4������������Nԭ�Ӻ�ÿ��Hԭ���γ�1�����õ��Ӷԣ���Nԭ�ӻ���һ���µ��Ӷԣ�����ʽΪ ![]() �����������д������Ӽ����ۼ��������Ӻ���������֮��������Ӽ���O��Oԭ��֮����ڹ��ۼ�������ʽΪ
�����������д������Ӽ����ۼ��������Ӻ���������֮��������Ӽ���O��Oԭ��֮����ڹ��ۼ�������ʽΪ ![]() ��
��
���Դ��ǣ� ![]() �����Ӽ����ۼ���
�����Ӽ����ۼ��� ![]() ��
��

����Ŀ����0.2mol��L-1��KI��Һ��0.05mol��L-1Fe2(SO4)3��Һ�������ϳ�ַ�Ӧ��ȡ���Һ�ֱ��������ʵ�飬��˵����Һ�д��ڻ�ѧƽ��2Fe3++2I��![]() 2Fe2++I2����
2Fe2++I2����
ʵ���� | ʵ����� | ʵ������ |
�� | ����KSCN��Һ | ��Һ���ɫ |
�� | ����AgNO3��Һ | �л�ɫ�������� |
�� | ����K3[Fe(CN)6]��Һ | ����ɫ�������� |
�� | ���������Һ | ��Һ����ɫ |
A�������� B�������� C�������� D��������