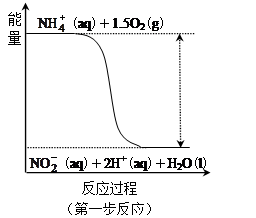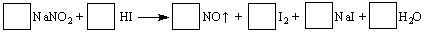题目内容
化学在日常生活中具有广泛的应用,下列应用中不涉及氧化还原反应原理的是
| A.用明矾[KAl(SO4)2·12H2O]净水 | B.海水中提取溴 |
| C.交警用CrO3检验司机是否酒后驾驶 | D.医务室用双氧水消毒 |
A
解析试题分析:明矾所含铝离子能水解生成氢氧化铝胶体,氢氧化铝胶体具有很强的吸附性,因此明矾可用于净水,但该反应中无元素化合价变化,因此不涉及氧化还原反应,故A正确;海水中溴元素以溴离子形式存在,海水提溴需要将溴的化合价由—1升为0价,因此涉及氧化还原反应,故B错误;三氧化铬中铬的化合价为+6,具有强氧化性,能将乙醇直接氧化为乙酸,铬元素由+6降为+3,因此检验酒驾涉及氧化还原反应,故C错误;双氧水具有强氧化性,其所含氧元素由—1降为—2价,因此双氧水消毒涉及氧化还愿反应,故D错误。
考点:考查氧化还原反应,涉及元素化合物的主要性质及应用、氧化还原反应的特征、元素的化合价等。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列反应中,水作为氧化剂的是
| A.SO2与H2O反应 | B.Al与NaOH溶液反应 |
| C.NO2与H2O反应 | D.Na2O2与H2O反应 |
已知:①向盛有稀H2SO4试管中加入Fe粉,Fe粉完全溶解得浅绿色溶液;
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液。
下列判断正确的是
| A.上述实验中,共涉及四个氧化还原反应 |
| B.实验可证明还原性:H+>Fe2+>OH->I- |
| C.实验②可证明溶解度:Fe(OH)3>Fe(OH)2 |
| D.实验③中,反应的离子方程式是:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O |
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |
制备食用碘盐(KIO3)原理之一为:I2 +2KClO3 Cl2 +2KIO3,下列说法正确的是
Cl2 +2KIO3,下列说法正确的是
| A.KClO3和KIO3均属于离子化合物,只含有离子键 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>Cl |
| C.为防止反应的尾气造成大气污染,可以用饱和食盐水吸收尾气 |
| D.制备KIO3的反应中I2被氧化 |
在NO2与水的反应中,NO2
| A.只是还原剂 |
| B.只是氧化剂 |
| C.既是还原剂,又是氧化剂 |
| D.既不是还原剂,又不是氧化剂 |
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
| A.产物PH3分子中所有的原子可能共平面 |
| B.该反应中P做还原剂,H2O做氧化剂 |
| C.相关元素的第一电离能的大小顺序:S>P>Si |
| D.该反应每发生0.3摩尔电子转移,PH3分子中就有0.3摩尔P-H键形成 |
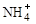 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下: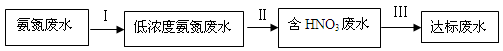
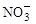 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下: