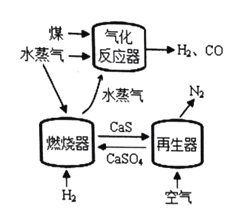
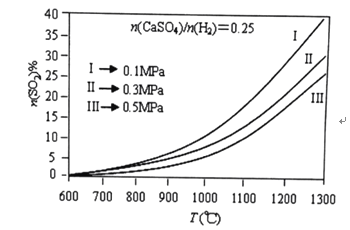
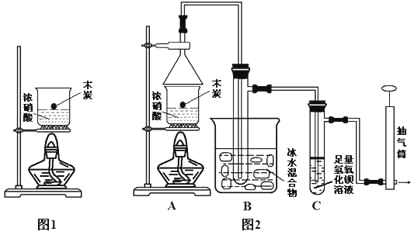
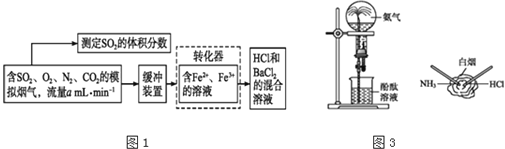
题目内容
【题目】某温度时,CuS、MnS 在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 ( )

A.该温度下,Ksp(CuS)小于 Ksp(MnS)
B.a 点对应的 Ksp 等于 b 点对应的 Ksp
C.在含有 CuS 和 MnS 固体的溶液中 c(Mn2+)∶c(Cu2+)=2×10-23∶1
D.向 CuSO4 溶液中加入 MnS 发生如下反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
【答案】C
【解析】
由图象可知当c(M2+)相同时,CuS固体的溶液中c(S2-)较小,则说明Ksp(CuS)较小,图象中处于曲线上的点为平衡点,即饱和溶液,利用平衡移动的影响因素分析。
A. 由图象可知,当c(M2+)相同时,CuS固体的溶液中c(S2-)较小,则说明Ksp(CuS)较小,故A正确;
B. a、b处于同一温度下,Ksp相同,故B正确。
C. 由图象可知,在此温度下,在含有CuS和MnS固体的溶液中c(Cu2+):c(Mn2+)=6×10-34:3×10-11=2×10-23:1,故C错误;
D. 因Ksp(CuS)小于Ksp(MnS),则向CuSO4溶液中加入MnS,可发生沉淀的转化,即Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),故D正确;
CuS(s)+Mn2+(aq),故D正确;
故选C。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
KSCN溶液 | Ⅰ | i.先加1 mL 0.1 mol/L FeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后退色 |
Ⅱ | iii.先滴加1 mL 0.05 mol/L Fe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
(1)①用离子方程式表示实验I溶液变红的原因___________
②针对实验I中红色褪去的原因,小组同学认为是SCN被酸性KMnO4氧化为SO42,并设计如图实验装置证实了猜想是成立的。
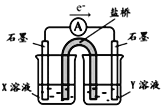
其中X溶液是_____________,检验产物SO42的操作及现象是__________。
(2)针对实验Ⅱ“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN难络合,于是小组设计了如下实验:
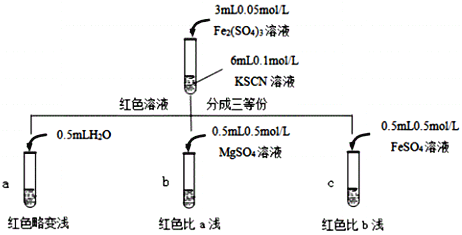
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________________。
【题目】I.利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合溶液最高温度。
回答下列问题:
(1)所用NaOH溶液要稍过量,理由是__。
(2)环形玻璃搅拌棒搅拌溶液的操作是__。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和H2SO4溶液代替NaOH溶液和盐酸,理由__。
(4)现将一定量的稀NaOH溶液、Ca(OH)2溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔΗ1、ΔΗ2、ΔΗ3,则ΔΗ1、ΔΗ2、ΔΗ3的大小关系为___。
II.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制250mL0.1000mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2–3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作4次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,消耗NaOH溶液的体(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 20.02 | 20.00 |
2 | 0.10 | 20.00 | 20.00 |
3 | 0.10 | 19.00 | 20.00 |
4 | 0.10 | 19.98 | 20.00 |
(1)步骤一需要称量氢氧化钠固体的质量为___g,配制标准溶液需要用到玻璃棒,烧杯外,还需要的玻璃仪器有___。
(2)根据上述数据,可计算出该盐酸的浓度为___(保留小数点后2位)。
(3)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏高的有__。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式:__MnO4-+__HSO3-+__H+=__
(2)用KMnO4进行滴定时,KMnO4溶液应装在___滴定管中(填酸式或碱式),判断滴定终点的现象是:滴入最后一滴KMnO4溶液时,___。