题目内容
16. 已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,
已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,X为金属元素且其基态原子中无未成对电子.请回答:
(1)X原子基态的核外电子排布式为1s22s22p2
(2)A元素形成的单质晶体中,不可能含有a(填序号)
a.离子键b.共价键c.金属键d.范德华力
(3)D的氢化物易溶于水,其水溶液中存在的氢键有4种,存在于该水溶液中与D氢化物的 分子互为等电子体的微粒是OH-(填化学式)
(4)B、C、D、X四种元素,电负性由大到小的顺序是F>O>N>Mg(用元素符号回答)
(5)A和B元素的最简氢化物分子,中心原子的杂化方式相同(填“相同”或“不同”)
(6)Y的氢化物比C的氢化物熔沸点高,其原因是CaH2是离子晶体,H2O是分子晶体,离子键比范德华力、氢键作用力强
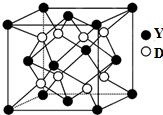
(7)D与Y形成的化合物为离子晶体,其晶胞如图,Y粒子的配位数是8.
分析 A、B、C、D、X、Y是原子序数依次增大的前20号元素,A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素,A~D的原子序数 是连号的,则B为N元素,C为O元素,D为F元素,X为金属元素,原子序数大于氟,只能处于第三周期,且X基态原子中无未成对电子,则X为Mg,X和Y位于同一主族,Y原子序数大于Mg,则Y为Ca,据此解答.
解答 解:A、B、C、D、X、Y是原子序数依次增大的前20号元素,A的基态原子有3个不同的能级,各能级中的电子数相等,原子核外电子排布式为1s22s22p2,故A为碳元素,A~D的原子序数 是连号的,则B为N元素,C为O元素,D为F元素,X为金属元素,原子序数大于氟,只能处于第三周期,且X基态原子中无未成对电子,则X为Mg,X和Y位于同一主族,Y原子序数大于Mg,则Y为Ca.
(1)X原子基态的核外电子排布式为:1s22s22p2,故答案为:1s22s22p2;
(2)A元素形成的单质有金刚石、石墨、C60等,金刚石属于原子晶体,含有共价键,石墨晶体为层状结构,层内碳原子之间形成共价键,层间为范德华力,有自由移动电子,含有金属键,C60为分子晶体,分子内碳原子之间形成共价键,分子间为范德华力,不可能含有离子键,故答案为:a;
(3)D的氢化物为HF,易溶于水,其水溶液中存在的氢键有:F-H…F、F-H…O、O-H…F、O-H…O共4种,溶液中与HF互为等电子体的微粒为OH-,故答案为:4;OH-;
(4)自左而右电负性增大,非金属性越强电负性越大,故电负性F>O>N>Mg,故答案为:F>O>N>Mg;
(5)A和B元素的最简氢化物分别为CH4、NH3,CH4分子中C原子形成4个C-H键,没有孤电子对,杂化轨道数目为4,NH3分子中N原子形成3个N-H键,有1对孤电子对,杂化轨道数目为4,中心原子均采取sp3杂化方式,故答案为:相同;
(6)Y的氢化物CaH2,C的氢化物为H2O,CaH2是离子晶体,H2O是分子晶体,离子键比范德华力、氢键作用力强,故CaH2的熔沸点高,故答案为:CaH2是离子晶体,H2O是分子晶体,离子键比范德华力、氢键作用力强;
(7)D与Y形成的化合物为离子晶体,化学式为CaF2,钙离子与氟离子配位数之比为2:1,每个氟离子周围有4个钙离子,氟离子配位数为4,则钙离子配位数为4×2=8,故答案为:8.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、氢键、电负性、杂化方式、晶体类型与性质、晶胞计算等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案
| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
| A. | 二氧化硅常被用来制造光导纤维和石英表中的压电材料 | |
| B. | 各国工业大量排放二氧化硫是全球气候变暖的主要原因 | |
| C. | 食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼 | |
| D. | 氯元素,禁入口中 |
| A. | 1mol的任何气体中都含有6.02×1023个分子 | |
| B. | 12g12C中含有6.02×1023个碳原子 | |
| C. | 1mol水中含有6.02×1023个氢原子 | |
| D. | 物质的量相等的CO和CO2所含的C原子个数也相等 |
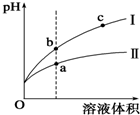 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH值变化曲线 | |
| B. | b点酸的总浓度大于a点酸的总浓度 | |
| C. | a点Kw的数值比c点Kw的数值大 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
| A. | 常温常压下,16克O3中含有的原子数为NA | |
| B. | 标准状况下,22.4L液溴中含有的分子数为NA | |
| C. | 1molH2O中含有的原子个数为NA | |
| D. | 0.1mol/L硫酸铝溶液中含有硫酸根的个数为0.3NA |


 →
→ +HBr.
+HBr. )是一种医药中间体.请设计合理方案用茴香醛(
)是一种医药中间体.请设计合理方案用茴香醛( )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).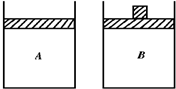 有两只相同的密闭容器A和B,A保持恒容,B保持恒压.起始时向这两只容器中分别充入等量的、物质的量比为4:5的NH3与O2的混合气体,并使A和B容积相等(如图所示),在保持500℃的条件下使之发生4NH3(g)+5O2(g)?4NO(g)+6H2O反应.填写下列空格:
有两只相同的密闭容器A和B,A保持恒容,B保持恒压.起始时向这两只容器中分别充入等量的、物质的量比为4:5的NH3与O2的混合气体,并使A和B容积相等(如图所示),在保持500℃的条件下使之发生4NH3(g)+5O2(g)?4NO(g)+6H2O反应.填写下列空格: