题目内容
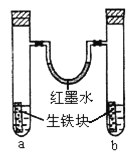
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
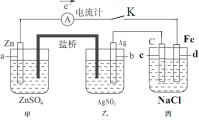
(1)乙中Ag电极的电极反应是___,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为___g;
(2)闭合电键K一段时间后,丙池中发生的总的化学方程式是___;
(3)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L此时测得丙池溶液质量实际减少3.75g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是___mol。
(4)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进___。
【答案】Ag++e-=Ag 0.65  0.165 “C”换成“Cu”、将“NaCl溶液”换成“CuSO4溶液”
0.165 “C”换成“Cu”、将“NaCl溶液”换成“CuSO4溶液”
【解析】
甲和乙形成有盐桥的原电池,相当于给丙外加电源,因此丙属于电解池,甲中a为活泼金属即失电子为负极,b中Ag为正极,丙中c电极连接原电池的正极属于阳极,d为阴极。
(1)乙中Ag为正极,其电极上是银离子得电子生成银单质,其电极反应为:Ag++e-=Ag;Zn从0价升高到+2价失去2个电子,已知电路中有0.02 mol电子通过,所以消耗的Zn为0.01 mol,![]() ;
;
(2)丙池中是电解NaCl溶液生产氢气、氯气和氢氧化钠,其电解方程式: ;
;
(3)已知碱0.1mol,![]()

2 1
0.1mol 0.05mol
因此:![]() ,
,![]() ,
,
丙池溶液质量实际减少4.23g,是氢气、氯气和氧气的质量和,所以![]() ,所以
,所以![]() ,
,
因此实际放出气体的物质的量是:0.1 mol + 0.05 mol +0.015mol=0.165 mol;
(4)要给丙中铁片上镀上一层Cu,根据镀层金属做阳极,镀件做阴极原理,则阳极应该为Cu电极,电解质溶液为硫酸铜溶液,所以要把C电极换成Cu电极,把NaCl溶液换为硫酸铜溶液。

练习册系列答案
相关题目