题目内容
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
【答案】CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr 不合理,未用硝酸中和氢氧化钠(未排除氢氧根离子的干扰) CH3CH2Br+NaOH
CH3CH2OH+NaBr 不合理,未用硝酸中和氢氧化钠(未排除氢氧根离子的干扰) CH3CH2Br+NaOH![]() CH2==CH2↑+NaBr+H2O CH2=CH2+Br2→CH2BrCH2Br 高锰酸钾溶液褪色 吸收乙醇
CH2==CH2↑+NaBr+H2O CH2=CH2+Br2→CH2BrCH2Br 高锰酸钾溶液褪色 吸收乙醇 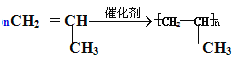
【解析】
(1)CH3CH2Br和NaOH水溶液加热时,二者发生取代反应生成乙醇;检验卤素原子必须中和过量的碱;
(2)加热条件下,溴乙烷和NaOH醇溶液发生消去反应生成乙烯;根据乙烯的不饱和性,能被高锰酸钾溶液氧化、能和乙烯加成反应,溶液褪色,乙醇能被高锰酸钾溶液氧化,溶液褪色,乙醇不能和乙烯反应;
(3)乙烯使溴水褪色,发生加成反应,据此写出的化学方程式;X是比乙烯相对分子质量大14的乙烯的同系物,X为丙烯,发生加聚反应生产塑料,据此写出化学方程式。
(1)CH3CH2Br和NaOH水溶液加热时,二者发生取代反应生成乙醇和NaBr,反应方程式为CH3CH2Br+NaOH![]() CH3CH2OH+NaBr;检验溴乙烷中含有溴元素,卤代烃水解后,加入硝酸酸化的硝酸银,硝酸酸化目的中和碱,否则生成氢氧化银沉淀,故:不合理,未用硝酸中和氢氧化钠(未排除氢氧根离子的干扰)。
CH3CH2OH+NaBr;检验溴乙烷中含有溴元素,卤代烃水解后,加入硝酸酸化的硝酸银,硝酸酸化目的中和碱,否则生成氢氧化银沉淀,故:不合理,未用硝酸中和氢氧化钠(未排除氢氧根离子的干扰)。
(2)加热条件下,溴乙烷和NaOH醇溶液发生消去反应生成乙烯,反应方程式为 CH3CH2Br+NaOH![]() CH2==CH2↑+NaBr+H2O,乙烯气体不溶于水,高锰酸钾能氧化乙烯,所以,它能使高锰酸钾溶液褪色,溴的四氯化碳溶液能和乙烯发生加成反应,所以,乙烯也能使溴水褪色,因装置1中用水,目的是防止乙醇和高锰酸钾反应,而溴与乙醇不反应,所以,无须用水;
CH2==CH2↑+NaBr+H2O,乙烯气体不溶于水,高锰酸钾能氧化乙烯,所以,它能使高锰酸钾溶液褪色,溴的四氯化碳溶液能和乙烯发生加成反应,所以,乙烯也能使溴水褪色,因装置1中用水,目的是防止乙醇和高锰酸钾反应,而溴与乙醇不反应,所以,无须用水;
(3)乙烯使溴水褪色,发生加成反应,据此写出的化学方程式:CH2=CH2+Br2→CH2BrCH2Br;X是比乙烯相对分子质量大14的乙烯的同系物,X为丙烯,发生加聚反应生产塑料,据此写出化学方程式: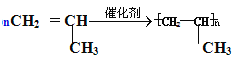 。
。

 阅读快车系列答案
阅读快车系列答案