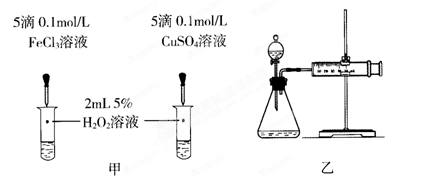
题目内容
Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-) 
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。
(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)氢氧化钠溶液 可将铜丝抽离液面已停止反应
(3)Cu2O为砖红色
(4)2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O 滴入最后一滴溶液,锥形瓶内溶液有蓝色变为无色,维持30s不变, 0.0011mol/L
解析试题分析:(1)金属铜和浓硫酸反应生成二氧化硫气体,根据质量守恒定律不难写出相关化学方程式。(2)
吸收未反应的二氧化硫气体和生成的二氧化碳气体,采用的尾气处理溶液为氢氧化钠溶液。把铜丝抽
离液面反应就可以停止。(3)氧化亚铜颜色为红色的;黑色物质不溶于硫酸,所以该黑色物质不可能是
氧化铜,应该是硫化铜;(4)?根据反应物和生成物不难写出相关离子方程式;当滴入最后一滴溶液,
锥形瓶内溶液由蓝色变成无色,且保持30s不变;消耗该Na2S2O3溶液体积,27.80ml-0.30ml=27.50ml,
关系式:Ba2+ - BaCrO4 -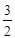 I2 -3 S2O32一;n(Ba2+)=
I2 -3 S2O32一;n(Ba2+)=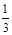 ×27.50×10-3L×0.0030mol·L-1=2.75×10-5mol,Ba2+的浓度为:
×27.50×10-3L×0.0030mol·L-1=2.75×10-5mol,Ba2+的浓度为: =1.1×10-3mol·L-1。
=1.1×10-3mol·L-1。
考点:考查铜和浓硫酸化学实验的探究,生活生产中有关滴定的相关计算。

实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题: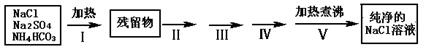
(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是 ;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液, | | |
| 步骤III: |  | |
| 步骤IV:过滤,往滤液中 | | |
| 步骤V:将溶液加热煮沸 |  | |
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为 mol/L(计算结果保留三位有效数字)。
用纯碱和双氧水混合可制作新型液体洗涤剂(2Na2CO3?3H2O2),它具有杀菌消毒去油污的能力且不会污染水源。
(1)检验这种新型洗涤剂中金属阳离子的操作和现象是______________________;
(2)这种洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成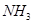 ,写出反应的离子方程式____________________________;
,写出反应的离子方程式____________________________;
(3)如果配制洗涤剂的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用离子方程式和简要文字表述):
__________________________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型洗涤剂的不良影响,取该洗涤剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.10 mol?Lˉ1NaOH溶液、8.0 mol?Lˉ1NaOH溶液、澄清石灰水、0.01 mol?Lˉ1KMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是_____; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | |
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;
②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;
③将镁粉放入液溴中,未观察到任何明显现象;
④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理论述中正确的是( )
| A.镁粉只直接与溴水中的溴反应 |
| B.镁粉只与溴水中的酸反应 |
| C.产生极少量的气泡是由于镁粉与水反应得到 |
| D.镁粉在水的催化下与溴发生反应 |
(12分)正丁醛是一种化工原料。某实验小组利用如右装置合成正丁醛。发生的反应如下: 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
| | 沸点/℃ | 密度/g·cm-3 | 水中溶解性 |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将Na2Cr2O7溶液与浓硫酸混合液放置在B中。在A中加入正丁醇和几粒沸石,加热,保持反应温度为90~95℃,在E中收集90℃以上的馏分。
将馏出物倒入分液漏斗中,除去水层,有机层干燥后蒸馏,收集75~77℃馏分。
回答下列问题:
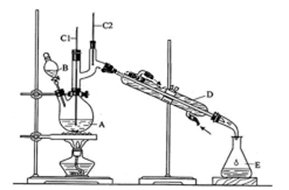
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。
(2)上述装置图中,B仪器的名称是 ,D仪器的名称是 。
(3)温度计的作用分别是C1 ;C2 。
(4)将正丁醛粗产品置于分液漏斗中水在 层(填“上”或“下”)。
(5)反应温度应保持在90~95℃,其原因是 。
下列广告语对应商品中含有的物质有误的是
| A.“红梅味精,领先(鲜)一步 ”——蛋白质 |
| B.“衡水老白干,喝出男人味”——乙醇 |
| C.“吃了钙中钙,腰不疼了,腿不痛了,腰杆也直了”——碳酸钙 |
| D.“要想皮肤好,早晚用大宝”——丙三醇 |
化学无处不在,下列与化学有关的说法不正确的是( )
| A.“神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中 四氧化二氮作氧化剂 |
| B.废弃的金属、纸制品、塑料袋、玻璃都是可回收资源 |
| C.2013年1月2日,印度金矿附近村庄出现砷中毒病例,砷中毒与环境污染有关 |
| D.从2012年3月15日起,国家规定食用碘盐中碘含量为20~30 mg·kg-1,加碘盐中 |
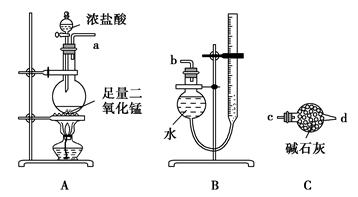
 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。