题目内容
向甲、乙两个容积均为1L的恒容容器中,分别充入2molA、2molB和1molA、1molB。相同温度下,发生反应:A(g)+B(g) xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
xC(g) △H<0测得两容器中c(A)随时间t的变化如图所示。
下列说法正确的是( )
A.甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙)
B.将乙容器升温可使甲、乙容器内各物质的体积分数相同
C.若向甲容器中再充入2molA、2molB,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/ L
D.x不可能等于2
CD
解析试题分析:A.甲乙两容器是在相同的温度下进行的,反应达到化学平衡时的平衡常数只与温度有关,与加入的物质的多少无关。温度相同 平衡常数就相同。错误。 B.该反应的正反应是放热反应,升温平衡向逆反应方向移动,导致C(A)增大,A的转化率减小且小于50%,甲中A的转化率为61%,只有甲乙容器中A的转化率相同时其体积分数才相同,因为将乙容器单独升温甲乙中的转化率不同,所以不能使乙容器内各物质的体积分数与甲容器内的相同,故B错误. C.向甲容器中再充入2molA、2molB,导致平衡体系的压强增大,平衡向正反应移动,A的转化率增大,即大于61%,假如平衡不移动,达到平衡时甲容器中A的浓度应该为2×0.78mol/L="1." 56mol/L.但由于平衡正向移动,所以导致C(A)的浓度要比1. 56mol/L小。向甲中再加入反应物时,平衡正向移动,但平衡移动的趋势是很微弱的,主要还是使物质的浓度增大。故浓度C(A)要大于0.78 mol/L。因此平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/ L正确。D、由图可知,甲容器加入2molA、2molB,反应达平衡后A的转化率为61%,乙容器充入1molA、1molB,反应达平衡后A的转化率为50%,即增大压强,A的转化率增大,增大压强平衡向体积减小方向移动即正反应方向移动,1+1>X,所以X=1,故D正确.
考点:考查浓度、温度、压强等外界条件对化学平衡的影响及平衡常数的计算的知识。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案某恒温密闭容器发生可逆反应

 ,在
,在 时刻反应达到平衡,在
时刻反应达到平衡,在 时刻缩小容器体积,
时刻缩小容器体积,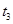 时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
| A.Z和W在该条件下至少有一个是为气态 |
B. 时间段与 时间段与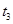 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
C.若在该温度下此反应平衡常数表达式为K=c(X),则 时间段与 时间段与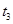 时刻后的X浓度不相等 时刻后的X浓度不相等 |
D.若该反应只在某温度 以上自发进行,则该反应的平衡常K随温度升高而增大 以上自发进行,则该反应的平衡常K随温度升高而增大 |
CO(g)+H2O(g) H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
H2(g)+CO2(g)△H﹤0,在其他条件不变的情况下,说法正确的是 ( )
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
在一密闭容器中进行以下可逆反应:M(g) + N(g)  P(g) + 2L。在不同的条件下P的百分含量P%的变化情况如图,则反应
P(g) + 2L。在不同的条件下P的百分含量P%的变化情况如图,则反应
| A.正反应放热,L是固体 | B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 | D.正反应放热,L是固体或气体 |
某温度下,体积一定的密闭容器中进行可逆反应:X(g)+Y(g) Z(g)+W(s) ΔH > 0,
Z(g)+W(s) ΔH > 0,
下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体密度不变时,反应达到平衡 |
| C.升高温度,Y的百分含量减少 |
| D.平衡后加入X,上述反应的ΔH增大 |
相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol) 乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol) 丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 |
| B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 |
| D.Y的转化率为:丁>乙>丙>甲 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2NH3(g)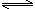 N2(g)+3H2(g) △H=+92.4kJ/mol
N2(g)+3H2(g) △H=+92.4kJ/mol
实验测的起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| NH3 | N2 | H2 | ||
| ① | 2 | 0 | 0 | 吸收热量akJ |
| ② | 0 | 1 | 3 | 放出热量bkJ |
| ③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是
A.热量关系:a=b
B.反应的平衡常数:③>①>②
C.达平衡时H2的体积分数:①>③
D.①中的密度不再改变时说明反应已达到平衡状态





 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是