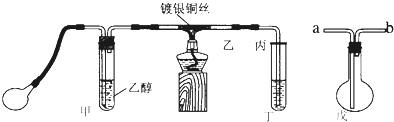
题目内容
6.下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是( )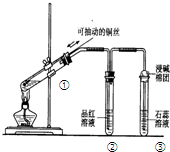
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液不褪色 | |
| C. | ③中石蕊溶液变蓝色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
分析 A.当铜丝与浓硫酸接触时才能反应;
B.根据SO2的漂白性分析,二氧化硫能使品红溶液褪色;
C.紫色石蕊溶液遇酸变红色;
D.硫酸密度大于水,应将试管中的溶液倒入水中,防止硫酸溅出伤人.
解答 解:Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
A.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;
B.二氧化硫能和有色物质反应生成无色物质而具有漂白性,二氧化硫能使品红溶液褪色,②中品红溶液褪色,故B错误;
C.二氧化硫进入③中,与水反应生成亚硫酸,使石蕊溶液变红色,故C错误;
D.由于试管①中有剩余的浓硫酸,浓硫酸溶于水会放出大量的热,且浓硫酸密度大于水,所以正确操作方法为:将试管①中的液体,慢慢倒入盛有少量水的试管中,观察溶液的颜色,二者顺序不能颠倒,故D错误;
故选A.
点评 本题考查二氧化硫的制备和性质,题目难度不大,注意A项,为制备二氧化硫的简易控制实验方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.烷烃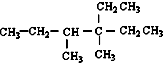 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有( )| A. | 3种 | B. | 4 | C. | 5种 | D. | 6种 |
1.下列说法正确的是( )
| A. | 除去Cu2+中的少量Fe3+,可加入CuO | |
| B. | 沸点:晶体硅>SiO2>SiCl4>NaCl | |
| C. | Cu(NH3)${\;}_{4}^{2+}$中的配位键是由Cu2+提供孤对电子,NH3提供空轨道形成的 | |
| D. | 石油的分馏、煤的液化以及煤的干馏等生产过程中均只发生物理变化 |
18.标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )
| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
15.下列反应属于加成反应的是( )
| A. | 甲烷与氯气混合光照 | B. | 苯、浓硝酸和浓硫酸混合共热 | ||
| C. | 用乙醇销毁金属钠 | D. | 乙烯使溴的四氯化碳溶液褪色 |
16.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | l.8 g818O2分子与1.8 g818O3分子中含有的中子数不相同 |
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: