题目内容
【题目】(1)已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0,请回答下列问题:
P(g)+Q(g) ΔH>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为________。
②若反应温度升高,M的转化率________(填“增大”、“减小”或“不变”)。
③若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=________。
④若反应温度不变,反应物的起始浓度为c(M)=c(N)=c(P)=c(Q)=2mol·L-1,此时v(正)_____v(逆)(填“>”、“<”或“=”)
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
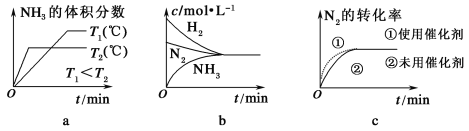
②对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
③相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
【答案】25%增大6<小a、c<<<
【解析】
(1)△c(M)=60%×1molL-1=0.6molL-1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6molL-1,故此时N的转化率0.6/2.4×100%=25%;综上所述,本题答案:25%。
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;综上所述,本题答案是:增大。
(3))△c(M)=60%×1molL-1=0.6molL-1,则:
M(g)+N(g)P(g)+Q(g);
初始(mol/L): 1 2.4 0 0
转化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
故该温度下平衡常数k=0.6×0.6/0.4×1.8=0.5;
反应温度不变,反应物的起始浓度分别为c(M)=4molL-1,c(N)=amolL-1;达到平衡后,c(P)=2molL-1,则:
M(g)+N(g)P(g)+Q(g);
初始(mol/L):4 a 0 0
转化(mol/L):2 2 2 2
平衡(mol/L):2 a-2 2 2
所以2×2/2×(a-2)=0.5,解得a=6,综上所述,本题答案:6。
④该反应的浓度商为QC=c(P)c(Q)/c(M)c(N)= 2×2/2×2=1,该温度下的平衡常数为0.5,QC>k,平衡左移,v(正) <v(逆);综上所述,本题答案:<。
(2)①该反应为放热反应,温度越高,平衡左移,平衡常数的值越小;综上所述,本题答案是:小。
②a.图像中曲线先出现拐点的先达到平衡,则T2温度高;升高温度,平衡逆向移动,则氨气的体积分数减小,但反应到达平衡的时间缩短,与图像一致,故正确;
b.反应到达平衡时,各物质浓度变化量之比等于其计量数之比,氢气与氨气浓度变化量之比为3:2,图像表示错误;故错误;
c.使用催化剂加快反应速率,缩短反应时间,但不影响平衡移动,氮气的转化率不变,符合题意,与图像一致,故正确;
综上所述,本题答案:a、c。
③恒容密闭容器A,反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;而恒压密闭容器B,均充入1 mol N2和3 mol H2,反应发生后总物质的量减少,由Pv=nRT可以知道,相对于A来说,相当于给B加压,则平衡正向移动,氨气的体积分数变大,所以a<b;生成的氨气多,反应向右进行的程度大,所以B中放出的热量多,则Q1<Q2;热化学方程式中反应热为完全反应放出的热量,而A中不能完全转化,放出的热量少,则Q1<92.4;综上所述,本题答案是: < , < , <。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案