题目内容
1.日本核电事故发生后,我国部分地区相继检测到极微量的人工放射性核素${\;}_{53}^{131}I$的原子核内中子数与核外电子数之差是( )| A. | 25 | B. | 53 | C. | 78 | D. | 131 |
分析 ${\;}_{53}^{131}$I中的中子数可由关系式:质量数=质子数+中子数,而核外电子数=质子数,由此可求出原子核内中子数与核外电子数之差.
解答 解:${\;}_{53}^{131}$I中的中子数N=质量数A-质子数Z=131-53=78,核外电子数=质子数=53,原子核内中子数与核外电子数之差为:78-53=25,
故选:A.
点评 本题考查了原子结构,明确关系式:质子数═核外电子数═原子序数═核电荷数和中子数N=质量数A-质子数即可解答,题目较为基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=a kJ•mol一1
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
CH3OH(l)=CH4(g)+$\frac{1}{2}$O2(g)△H=b kJ•mol一1
CO2(g)+2H2O(g)=CH3OH(l)+$\frac{3}{2}$O2(g)△H=+638.5 kJ•mol一1
则下列叙述正确的是( )
| A. | 甲烷的燃烧热为a kJ•mol-1 | B. | a一定大于0 | ||
| C. | a+b=-638.5 | D. | b一定小于0 |
12.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族.下列说法正确的是( )
| A. | 离子半径:r(Y2-)>r(Z2+) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物弱 | |
| D. | X、Y、Z、W所有元素的最高正价等于其所在族的族序数 |
16.常温下,以下溶液中c(H+)最小的是( )
| A. | pH=0的某溶液 | B. | 0.1 mol•L-1 NaOH 溶液 | ||
| C. | 0.1mol•L-1 HCl 溶液 | D. | 0.1 mol•L-1的 NaCl 溶液 |
6.某有机物在O2中充分燃烧生成CO2和H2O的物质的量之比为1:2,由此可得出的结论是( )
| A. | 该有机物分子中C、H、O原子个数比为1:4:1 | |
| B. | 该有机物分子中C、H原子个数比为1:4 | |
| C. | 该有机物中必定含有氧元素 | |
| D. | 该有机物化学式为CH4O |
11.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 10ml0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) | |
| D. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) |
 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答: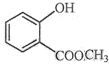 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.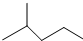 表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3.
表示的分子式为C6H14;2-甲基-2-丁烯的结构简式为CH3C (CH3)=CHCH3. .
.