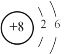题目内容
【题目】在密闭容器中的一定量A、B混合气体发生反应:aA(g)+bB(g)![]() cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
cC(g)。平衡时测得A的浓度为0.5mol/L;保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度为0.28mol/L。下列有关判断正确的是
A. a+b=cB. 该变化使平衡正向移动
C. B的转化率降低D. C的体积分数增大
【答案】C
【解析】
反应aA(g)+bB(g)cC(g)平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,若平衡不移动,B的浓度为0.25mol/L,而再达平衡时,测得A的浓度为0.28mol/L,则说明体积增大(压强减小)化学平衡逆向移动。
A.减小压强平衡向气体体积增大的方向移动,平衡逆向移动,所以a+b>c,故A错误;
B.平衡逆向移动,故B错误;
C.平衡逆向移动,B的转化率降低,故C正确;
D.平衡逆向移动,C的体积分数减小,故D错误;
故答案为C。

 世纪百通期末金卷系列答案
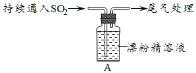
世纪百通期末金卷系列答案【题目】某小组对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.出现浑浊,溶液变为黄绿色; ⅱ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是_________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是______________________。
(3)甲同学认为现象i中溶液变为黄绿色的可能原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是___________________。
(4)乙同学通过实验确定了A瓶中大量白色沉淀是CaSO4,并用离子方程式解释了现象ⅱ中黄绿色褪去的原因是________。
【题目】用0.1320mol/L的HCl溶液滴定未知浓度的NaOH溶液,实验数据如下表所示,
实验编号 | 待测NaOH溶液的体积/mL | HCl溶液的体积/mL |
1 | 25.00 | 24.41 |
2 | 25.00 | 24.39 |
3 | 25.00 | 24.60 |
回答下列问题:
(1)如图中甲为___________滴定管,乙为_________ 滴定管(填“酸式”或“碱式 ”)
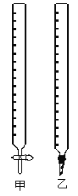
(2)实验中,需要润洗的仪器是:________________________
(3)取待测液NaOH溶液25.00ml 于锥形瓶中,使用酚酞做指示剂。滴定终点的判断依据是________________________________________
(4)若滴定前,滴定管尖端有气泡,滴定后气泡消失,将使所测结果____________(填“偏高”“偏低”“不变”,下同);若读酸式滴定管读数时,滴定前仰视读数,滴定后正确读数,则所测结果___________。
(5) 未知浓度的NaOH溶液的物质的量浓度为_____________mol/l。
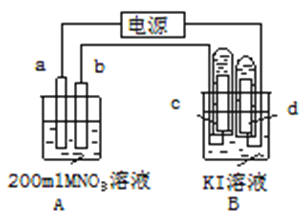
【题目】硝酸是氧化性酸,其本质是NO![]() 有氧化性,某课外实验小组进行了下列有关NO
有氧化性,某课外实验小组进行了下列有关NO![]() 氧化性的探究(实验均在通风橱中完成)。
氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
⑴写出铜与稀硝酸反应的离子方程式_____。
⑵实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_____。
⑶实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是______。
查阅资料:活泼金属与1mol·L-1稀硝酸反应有H2和NH![]() 生成,NH
生成,NH![]() 生成的原理是产生H2的过程中NO
生成的原理是产生H2的过程中NO![]() 被还原。
被还原。
⑷用如图装置进行实验Ⅲ:溶液X为1mol·L-1稀硝酸溶液,观察到电流计指针向右偏转。反应后的溶液中含NH![]() 。生成NH
。生成NH![]() 的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
的电极发生的反应是_____(填“氧化反应”或“还原反应”)。
⑸进一步探究碱性条件下NO![]() 的氧化性,进行实验Ⅳ(如图):
的氧化性,进行实验Ⅳ(如图):
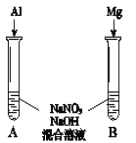
①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的原因是_____。
②A中生成NH3的离子方程式是______。
⑹将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由______。