题目内容
8.下列化学式既能表示物质的组成,又能表示物质的一个确定分子的是( )| A. | NaOH | B. | SiO2 | C. | C3H6 | D. | C3H8 |
分析 化学式既能表示物质的组成,又能表示物质的一个分子的应是分子晶体物质,晶体中含有单个分子,又能表示物质的一个确定分子,说明无同分异构体,而离子晶体、原子晶体和金属晶体无单个分子.
解答 解:A.NaOH为离子晶体,化学式为晶体中阴阳离子的个数比,晶体中不含单个分子,故A错误;
B.SiO2为原子晶体,晶体中不存在单个分子,化学式为Si原子与O原子的个数比值为1:2,故B错误;
C.C3H6的物质,可以为烯烃,也可以为环烷烃,结构简式为:CH2═CH-CH3、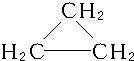 ,不能表示物质的一个确定分子,故C错误;
,不能表示物质的一个确定分子,故C错误;
D.C3H8是烷烃丙烷的化学式,无同分异构体,只能表示一个丙烷分子,故D正确;
故选D.
点评 本题考查晶体类型的判断,题目难度不大,注意只有分子晶体才含有单个分子,化学式即分子式,易错点为C注意同分异构体.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
5.标准状况下,将5.6L由CO、CH4、C2H4、C2H2组成的混合气体与18LO2混合于某密闭容器中点燃,反应完成后再恢复到原状况,得CO2气体7.50L,则下列判断正确的是( )
| A. | 反应完成后,O2有剩余 | |
| B. | 原混合气体中,C2H4与C2H2的体积共为1.9L | |
| C. | 反应完成后,生成水的质量为9g | |
| D. | 原混合气体中,CO与CH4的体积比一定为1:1 |
19.影响化学反应速率的主要因素是( )
| A. | 温度 | B. | 催化剂 | C. | 物质的性质 | D. | 浓度 |
16.钾离子是细胞内液的主要阳离子,体内98%的钾存在于细胞内.经检测某饮用矿泉水中K+浓度为5.85mg/L,该矿泉水中c(K+)/mmol•L-1为( )
| A. | 1.5 | B. | 0.10 | C. | 0.15 | D. | 1.00 |
13.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0mol•L-1,则下列说法中正确的是( )
| A. | 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g•cm-3 | |
| B. | 此溶液中KCl的质量分数为$\frac{74.5}{1.174×1000}$×100% | |
| C. | 密度大于1.174 g•cm-3的KCl溶液是过饱和溶液 | |
| D. | 25℃时,饱和KCl溶液的浓度大于4.0 mol•L-1 |
20.(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如表所示:
①三种元素电负性大小关系为Z>Y>X
②写出Y原子的电子排布式1s22s22p63s2 Y的第一电离能大于Z的第一电离能的原因Y元素原子最外层s轨道上的电子为全满
③X晶体采用图1中A(填字母) 堆积方式.
(2)N2O的等电子体为:①分子CO2,②阴离子SCN- 或N3-;由此可知N2O的中心原子的杂化类型为SP.根据价层电子对互斥模型确定NO2的分子构型为:V型.
(3)已知铜能形成多种化合物,如硫酸铜的结构如图2所示,请在图中标出水合铜离子中的配位键.

| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| 9540 | 10540 | 11578 |
②写出Y原子的电子排布式1s22s22p63s2 Y的第一电离能大于Z的第一电离能的原因Y元素原子最外层s轨道上的电子为全满
③X晶体采用图1中A(填字母) 堆积方式.
(2)N2O的等电子体为:①分子CO2,②阴离子SCN- 或N3-;由此可知N2O的中心原子的杂化类型为SP.根据价层电子对互斥模型确定NO2的分子构型为:V型.
(3)已知铜能形成多种化合物,如硫酸铜的结构如图2所示,请在图中标出水合铜离子中的配位键.

17.以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2mol Fe(OH)3沉淀.此过程中共消耗水( )
| A. | 3mol | B. | 4mol | C. | 5mol | D. | 6mol |
18.下列说法中正确的是( )
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 | |
| D. | 单质的晶体中一定不存在的微粒是阳离子 |