题目内容
3.写出实验室利用MnO2跟浓盐酸在加热条件下制取氯气反应的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,该反应中还原剂与氧化剂物质的量之比是2:1.分析 MnO2与浓盐酸在加热条件下发生氧化还原反应生成氯气;元素化合价升高的做还原剂,元素化合价降低的做氧化剂,据此分析计算二氧化锰与浓盐酸发生反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高,根据化合价的变化可知电子的转移方向和数目;得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂.
解答 解:二氧化锰与浓盐酸发生反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,Mn元素化合价由+4价降低到+2价,Cl元素化合价由-1价升高,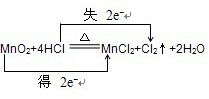 ,Mn元素化合价由+4价降低到+2价,所以二氧化锰为氧化剂,Cl元素化合价由-1价升高为0价,结合化学方程式中元素化合价变化,所以HCl为还原剂,反应中还原剂与氧化剂物质的量之比是2:1,
,Mn元素化合价由+4价降低到+2价,所以二氧化锰为氧化剂,Cl元素化合价由-1价升高为0价,结合化学方程式中元素化合价变化,所以HCl为还原剂,反应中还原剂与氧化剂物质的量之比是2:1,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,2:1.
点评 本题考查了氯气的实验室制法、氧化还原反应的规律以及根据氧化还原反应方程式进行计算,解题关键在于明氧化还原反应关系,题目难度不大.

练习册系列答案
相关题目
20.天然维生素P(结构简式如图所示)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述中错误的是( )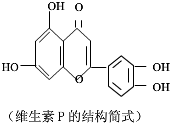

| A. | 可与NaOH溶液反应,1mol该物质可与4mol NaOH反应 | |
| B. | 可与溴水反应,且1mol该物质与足量溴水反应消耗6mol Br2 | |
| C. | 一定条件下1mol该物质可与H2加成,耗H2最大量为7mol | |
| D. | 维生素P遇FeCl3溶液发生显色反应 |
14.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:1,则下列说法中正确的是( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中含有氧原子 | D. | 此有机物的最简式为为CH4 |
11.下列说法正确的是( )
| A. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A一定是强酸 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氨水,选用最佳指示剂为酚酞 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 常温下,强酸溶液的pH=a,将溶液的体积稀释到原来的10n倍,则pH=a+n |
18.下列物质可以用作药物,用于治疗胃酸过多的是( )
| A. | BaCO3 | B. | NaOH | C. | CuSO4 | D. | Al(OH)3 |
8.下列化学式既能表示物质的组成,又能表示物质的一个确定分子的是( )
| A. | NaOH | B. | SiO2 | C. | C3H6 | D. | C3H8 |
15.下列说法正确的是( )
| A. | 淀粉和纤维素互为同分异构体,都能水解为还原性的糖 | |
| B. | 用灼烧的方法可鉴别毛织物和棉织物 | |
| C. | 鸡蛋白溶液中加入浓的硫酸铵溶液有沉淀析出,加水后沉淀不溶解 | |
| D. | 天然油脂有的具有固定的熔沸点,植物油不能使溴的四氯化碳溶液褪色 |
12.在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)?xC(g)有图Ⅰ和图Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示C的体积分数),试判断下列说法中正确的是( )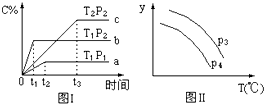

| A. | 正反应为放热,T1>T2 | |
| B. | x=1,P2<P1 | |
| C. | y轴表示混合气体的平均分子量,P3<P4 | |
| D. | y轴表示B的转化率,P3>P4 |
13.下列叙述中正确的是( )
| A. | 22.4L氧气中必然含有6.02×1023个氧分子 | |
| B. | 同温同压下,原子数均为6.02×1023个的氢气和氦气具有相同的体积 | |
| C. | 0.50mol的硫酸钠中含有6.02×1023个钠离子 | |
| D. | 1.0L浓度为1.0mol•L-1的一元酸溶液中含有 6.02×1023个氢离子 |