题目内容
20.(1)已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ/mol)如表所示:| X | Y | Z | |
| I1 | 496 | 738 | 577 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2754 |
| 9540 | 10540 | 11578 |
②写出Y原子的电子排布式1s22s22p63s2 Y的第一电离能大于Z的第一电离能的原因Y元素原子最外层s轨道上的电子为全满
③X晶体采用图1中A(填字母) 堆积方式.
(2)N2O的等电子体为:①分子CO2,②阴离子SCN- 或N3-;由此可知N2O的中心原子的杂化类型为SP.根据价层电子对互斥模型确定NO2的分子构型为:V型.
(3)已知铜能形成多种化合物,如硫酸铜的结构如图2所示,请在图中标出水合铜离子中的配位键.

分析 (1)根据元素电离能的变化知,X为第ⅠA族元素、Y为第ⅡA族元素、Z为第ⅢA族元素,又X、Y、Z为同一周期的三种元素,而且X为第ⅠA族元素可以失去4个电子,则这几种元素为第三周期,分别是Na、Mg、Al元素,
①元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小;
②根据Y为镁元素,原子的核外电子数为12,再根据核外电子排布规律来写;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
③钾、钠和铁型,体心立方堆积,镁、锌、钛型,六方最密堆积,面心立方最密堆积(Cu型),据此分析解答;
(2)原子个数相等且价电子数相等的分子为等电子体;根据价层电子对互斥理论确定分子空间构型及原子杂化方式;
(3)含有孤电子对的原子和含有空轨道的原子之间能形成配位键.
解答 解:(1)根据元素电离能的变化知,X为第ⅠA族元素、Y为第ⅡA族元素、Z为第ⅢA族元素,根据元素的第一电离能知,这几种元素分别是Na、Mg、Al元素,
①一般来说,元素非金属性越强电负性越小,金属性越强,电负性越小,同周期自左而右电负性增大,Na、Mg、Al属于同周期元素,Na<Mg<Al,
即Z>Y>X,
故答案为:Z>Y>X;
②Mg元素为12号元素,原子核外有12个电子,所以核外电子排布式为:1s22s22p63s2,Y、Z元素处于同一周期且原子序数逐渐增大,但Y为镁元素,处于第ⅡA族,最外层s轨道上的电子为全满,所以Y的第一电离能大于Z,
故答案为:1s22s22p63s2;Y元素原子最外层s轨道上的电子为全满;
③钠属于体心立方堆积,
故答案为:A;
(2)①N2O中原子个数是3价电子数是16,含有3个原子且价电子数是16的有二氧化碳,
故答案为:CO2;
②原子个数为3价电子数为16的离子有SCN- 或N3-等,N2O的中心原子含有2个价层电子对且不含孤电子对,为sp杂化,NO2的中心原子价电子对个数是2.5且含有一个孤电子,为V型,
故答案为:SCN- 或N3-;sp;V型;
(3)该配合物中,铜原子提供空轨道,水中氧原子提供孤电子对,配位键由提供孤电子对的原子指向提供空轨道的原子,所以其表示方法为: ,
,
故答案为: .
.
点评 本题考查了物质结构和性质,涉及电离能、电负性、等电子体、配位键的表示方法、分子空间构型的判断、原子杂化方式的判断、晶体类型等知识点,这些点都是考试热点,知道配位键箭头的指向,熟练掌握空间构型的判断方法、原子杂化方式的判断方法是解答关键,题目难度中等.

| A. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A一定是强酸 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氨水,选用最佳指示剂为酚酞 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 常温下,强酸溶液的pH=a,将溶液的体积稀释到原来的10n倍,则pH=a+n |
| A. | NaOH | B. | SiO2 | C. | C3H6 | D. | C3H8 |
| A. | 淀粉和纤维素互为同分异构体,都能水解为还原性的糖 | |
| B. | 用灼烧的方法可鉴别毛织物和棉织物 | |
| C. | 鸡蛋白溶液中加入浓的硫酸铵溶液有沉淀析出,加水后沉淀不溶解 | |
| D. | 天然油脂有的具有固定的熔沸点,植物油不能使溴的四氯化碳溶液褪色 |
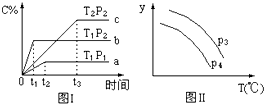
| A. | 正反应为放热,T1>T2 | |
| B. | x=1,P2<P1 | |
| C. | y轴表示混合气体的平均分子量,P3<P4 | |
| D. | y轴表示B的转化率,P3>P4 |
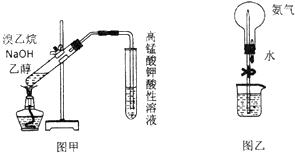
| A. | 如图甲,检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| B. | 如图乙,做喷泉实验时先挤压胶头滴管使水进入烧瓶,后松开止水夹 | |
| C. | 酸碱中和滴定前,滴定管和锥形瓶在用蒸馏水洗涤后均需用待装溶液润洗 | |
| D. | 用托盘天平称取1.06g无水碳酸钠,溶于250mL水,配制0.04 mol•L-1Na2CO3溶液 |
| A. | 2-甲基-1-丁烯 | B. | 裂化汽油 | C. | 苯 | D. | 邻二甲苯 |
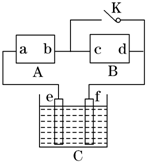 如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图所示,A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: