题目内容
关于10mL0.1 mol.·L-1的NH3 ? H2O溶液,下列说法正确的是
| A.25°C时,若溶液的 pH=11,则 Kb(NH3 ? H2O) = 1X10-6 mol.L-1 |
B.向溶液中加入少量CH3COONa固体,溶液中 的值变小 的值变小 |
| C.向溶液中加入10mL 0.1 mol.L-1HC1,所得溶液中离子浓度大小顺序为C(NH4+)>C(Cl-)>C(H+)>C(OH-) |
| D.向溶液中加入5mL0.1mol/LHC1,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
D
解析试题分析:有pH=11,知c(OH-)=c(NH4+)=10-3mol/L,c(NH3 ? H2O)="0.1mol/L," Kb(NH3 ? H2O)=1×10-5mol.L-1A错;B、向溶液中加入少量CH3COONa固体,CH3COONa水解显碱性,氨水电离平衡逆向移动, 的值变大,B错;C、向溶液中加入10mL 0.1 mol.L-1HC1,恰好反应得到NH4Cl溶液,NH4+水解,c(NH4+)<c(Cl-),C错,D符合电荷守恒,正确。
的值变大,B错;C、向溶液中加入10mL 0.1 mol.L-1HC1,恰好反应得到NH4Cl溶液,NH4+水解,c(NH4+)<c(Cl-),C错,D符合电荷守恒,正确。
考点:考查水解平衡和水解常数计算,离子浓度比较

练习册系列答案
相关题目
己知H2CO3的酸性强于H2S,将amol·L -1 NaHS与bmol·L-1NaOH两种稀溶液等体积混合(a>0,b>0),所得溶液中微粒间的物质的量浓度关系正确的是
| A.a=b时:c(OH-)= c(H+)+c(HS-) |
| B.a=2b时:c(S2-)>c(HS )>c(OH-)>c(H+) |
| C.a=3b时:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D.a=4b时:4c(Na+)=5c(S2-)+5c(HS-)5c(H2S) |
常温下,有关醋酸溶液的叙述中错误的是
| A.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COOˉ) |
| B.将pH=3的醋酸稀释为pH=4的过程中,c(CH3COOH)/ c(H+)比值不变 |
| C.浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后:c(CH3COOˉ)+ c(CH3COOH)="2" c(Na+) |
| D.amLpH=3的醋酸溶液与bmLpH=11的NaOH溶液恰好完全中和时,a=b |
对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A.c(H+)=c(CH3COO-) + c(OH-) |
| B.加水稀释到原体积的10倍后溶液pH变为4 |
| C.加入少量乙酸钠固体,溶液pH降低 |
| D.与等体积pH为11的NaOH溶液混合后所得溶液中:c(Na+)=c(CH3COO-) |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
下列说法中,正确的是( )
| A.粗铜精炼时,阳极产生0.5molCu2+则阴极有NA个Cu原子析出 |
| B.因为酸性H2SO3>H2CO3,所以S得电子能力大于C |
| C.可通过比较Mg(OH)2和MgCO3的Ksp的大小 比较它们的溶解性 |
| D.含0.1molNaClO的溶液蒸干可得5.85gNaCl固体 |
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
含SO2的烟气会形成酸雨,工业上常利用Na2SO3溶液作为吸收液脱除烟气中的SO2。随着SO2的吸收,吸收液的pH不断变化。下列粒子浓度关系一定正确的是:
A.Na2SO3溶液中存在: |
B.已知NaHSO3溶液 ,该溶液中: ,该溶液中: |
C.当吸收液呈中性时: |
D.当吸收液呈酸性时: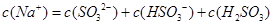 |
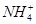 )由大到小的顺序为________;
)由大到小的顺序为________;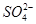 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(