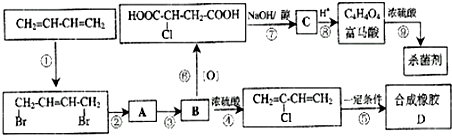
题目内容
10.近期“五水共治”越来越引起人们的重视.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.(1)含乙酸钠和对氯酚(
 )的废水可以通过构成微生物电池除去,其原理如图所示.
)的废水可以通过构成微生物电池除去,其原理如图所示.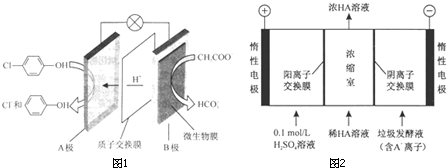
①B是电池的负极(填“正”或“负”);②A极的电极反应式为Cl-
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).
①阳极的电极反应式为4OH--4e-═2H2O+O2↑;
②简述浓缩室中得到浓乳酸的原理阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大;
③400mL10g/L 乳酸溶液通电一段时间后,浓度上升为 145g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为6.72L(乳酸的摩尔质量为90g/mol ).
分析 (1)①根据原电池中阳离子的移动方向确定正负极;
②根据原电池中正极上得电子结合正极反应物来分析解答;
(2)①电解池中阳极上氢氧根离子失电子生成氧气;
②根据电解池中离子移动方向来回答判断;
③根据电极反应式结合原子守恒来计算.
解答 解:(1)①原电池中氢离子的移动方向是从负极流向正极,所以B是电池的负极,故答案为:负;
②A是正极,正极上发生得电子的还原反应:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-,故答案为:Cl-
-OH+Cl-,故答案为:Cl- -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-;
-OH+Cl-;
(2)①阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,故答案为:4OH--4e-═2H2O+O2↑;
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大,
故答案为:阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室,A-通过阴离子交换膜从阴极进入浓缩室,H++A-═HA,乳酸浓度增大;
③在阳极上发生电极反应:4OH--4e-═2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA~H+~$\frac{1}{2}$H2,根据差值法,乳酸的浓度变化量是$\frac{145g•{L}^{-1}-10g•L{\;}^{-1}}{90g/mol}$=1.5mol/L,即生成HA的物质的量是1.5mol/L×0.4L=0.6mol,所以产生氢气是0.3mol即0.3mol×22.4L/mol=6.72L,
故答案为:6.72;
点评 本题涉及电解池和原电池的工作原理以及应用的考查,注意知识的迁移和应用是解题的关键,难度中等,注意把握原电池和电解池中离子的移动方向.

 全优点练单元计划系列答案
全优点练单元计划系列答案
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | | 315 | |
| 熔点/℃ | -70.0 | -107.2 | | | |
| 升华温度/℃ | 180 | 300 | 162 |
请回答下列问题:
(1)装置A中g管的作用是平衡压强;装置C中的试剂是浓硫酸;装置E中的h 瓶需要冷却的理由是使SiCl4冷凝收集.
(2)装置E中h瓶收集到的粗产物可通过酒精(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是Al、P(填写元素符号).
| A. | 质子总数 | B. | 质量 | C. | 密度 | D. | 原子总数 |
| A. | 冰融化一一共价键 | B. | 氢氧化钠熔融--离子键、共价键 | ||
| C. | 氯化氢溶于水--范德华力 | D. | 硫酸氢钠溶于水--离子键、共价键 |
| A. | 卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| C. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| D. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |
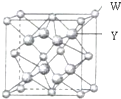 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题: