题目内容
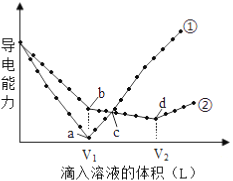
【题目】常温下,浓度均为0.1mol/L、100mL的Ba(OH)2溶液中,分别滴入浓度均为0.1mol/L的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。
(1) 0.1mol/L的NaHSO4溶液pH=_____________。
(2)曲线___________代表滴加H2SO4溶液的变化曲线。b点溶液的酸碱性为___________(酸性或碱性或中性)。
(3)d点溶液中主要离子种类:______________。
【答案】 1 ① 碱性 Na+、SO42-
【解析】试题分析:本题考查溶液pH的计算,酸碱混合后导电能力图像的分析,离子反应和溶液酸碱性的判断。
(1)NaHSO4属于强酸的酸式盐,其在水溶液中的电离方程式为NaHSO4=Na++H++SO42-,0.1mol/LNaHSO4溶液中c(H+)=0.1mol/L,溶液的pH=1。
(2)Ba(OH)2溶液中加入H2SO4发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O;Ba(OH)2溶液中加入NaHSO4溶液,随着NaHSO4的加入依次发生反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH、NaOH+NaHSO4=Na2SO4+H2O;当Ba(OH)2与H2SO4恰好完全反应时,溶液中离子物质的量浓度最小且接近0,导电能力最小接近0,曲线①中a点导电能力最小接近0,则曲线①代表滴加H2SO4溶液的变化曲线;曲线②代表滴加NaHSO4溶液的变化曲线。b点在曲线②上,a点在曲线①上,b点与a点加入的溶液体积相等,a点Ba(OH)2与H2SO4恰好完全反应,Ba(OH)2与H2SO4物质的量相等,则b点Ba(OH)2与NaHSO4物质的量相等,发生反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,b点为NaOH溶液,b点溶液呈碱性。
(3)d点在曲线②上,导电能力最小,d点Ba(OH)2与NaHSO4的反应为Ba(OH)2+2NaHSO4=BaSO4↓+2H2O+Na2SO4,d点为Na2SO4溶液,溶液中主要离子为Na+、SO42-。