��Ŀ����
����Ŀ��������ѧ֪ʶ�����Ŀ��
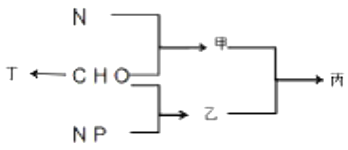
��1���й��Ŵ��Ĵ���֮һ�����ڻ�ҩ�����ı�ը��ӦΪ��2KNO3+3C+S ![]() A+N2��+3CO2��������ƽ�� �ٳ�S�⣬����Ԫ�صĵ縺�ԴӴ�С����Ϊ��
A+N2��+3CO2��������ƽ�� �ٳ�S�⣬����Ԫ�صĵ縺�ԴӴ�С����Ϊ��
�����������У������Թ��ۼ��ķ��ӵ�����ԭ�ӹ���ӻ�����Ϊ �� A�ľ�������Ϊ ��
����֪CN����N2�ṹ���ƣ�����HCN�����ЦҼ���м���Ŀ֮��Ϊ ��
��2��ԭ������С��36��Ԫ��Q��T�������ڱ��мȴ���ͬһ������λ��ͬһ�壬��ԭ������T��Q��2��T�Ļ�̬ԭ����Χ���ӣ��۵��ӣ��Ų�Ϊ �� Q2+��δ�ɶԵ������� ��
��3����CrCl3��ˮ��Һ�У�һ�������´������Ϊ[CrCln��H2O��6��n]x+��n��x��Ϊ���������������ӣ�����ͨ�������ӽ�����֬��R��H�����ɷ������ӽ�����Ӧ��[CrCln��H2O��6��n]x++xR��H��Rx[CrCln��H2O��6��n]+xH+����������H+���к͵ζ����������x��n��ȷ�������ӵ���ɣ�����0.0015mol[CrCln��H2O��6��n]x+����Һ����R��H��ȫ�������к����ɵ�H+��Ũ��Ϊ0.1200molL��1NaOH��Һ25.00mL����֪�������ӵĻ�ѧʽΪ ��
���𰸡�
��1��O��N��C��K��sp�����Ӿ��壻1��1
��2��3d84s2��1��1
��3��[CrCl��H2O��5]2+
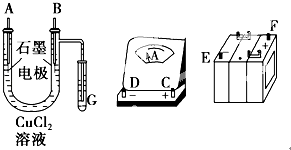
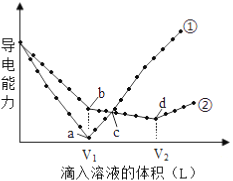
���������⣺��1����ͬ����������ҵ縺����������Խǿ�縺��ԽС���ʵ縺��O��N��C��K�����Դ��ǣ�O��N��C��K���ں����Թ��ۼ��ķ���ΪCO2 �� ������Cԭ���γ�2��C=O���������¶Ե��ӣ��ӻ������ĿΪ2��Ϊsp�ӻ���ʽ����ԭ���غ��֪������AΪK2S���������Ӿ��壬���Դ��ǣ�sp�����Ӿ��壻��CN����N2�ṹ���ƣ�Cԭ����Nԭ��֮���γ���������HCN���ӽṹʽΪH��C��N�������к���1���Ҽ���2���м����������ڦҼ�����HCN�����ЦҼ���м���Ŀ֮��Ϊ1��1�����Դ��ǣ�1��1����2��ԭ������С��36��Ԫ��Q��T�������ڱ��мȴ���ͬһ������λ��ͬһ�壬��Q��T���ڵڢ��壬��ԭ������T��Q��2����QΪFeԪ�أ�TΪNiԪ�أ�NiԪ����28��Ԫ�أ�Niԭ�Ӽ۵����Ų�ʽΪ3d84s2 �� Fe2+�ĺ�������Ų�ʽΪ1s24s22p63s23d6 �� 3d�ܼ���4�������ӣ����Դ��ǣ�3d84s2��4����3���к����ɵ�H+��Ũ��Ϊ0.1200mol/L����������Һ25.00mL������Եó�H+�����ʵ���Ϊ0.12mol/L��25.00��10��3L=0.0030mol������x= ![]() =2��Cr�Ļ��ϼ�Ϊ+3�ۣ����[CrCln��H20��6��n]x+ �� ��3��n=2�����Ե�֪n=1�����������ӵĻ�ѧʽΪ[CrCl��H2O��5]2+ �� ���Դ��ǣ�[CrCl��H2O��5]2+ ��
=2��Cr�Ļ��ϼ�Ϊ+3�ۣ����[CrCln��H20��6��n]x+ �� ��3��n=2�����Ե�֪n=1�����������ӵĻ�ѧʽΪ[CrCl��H2O��5]2+ �� ���Դ��ǣ�[CrCl��H2O��5]2+ ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�