��Ŀ����
����Ŀ�����Ĺ̶��Ǽ���������ѧ��һֱ�о��Ŀ��⡣
��1���±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���Kֵ��

�ٷ������ݿ�֪�������̵���Ӧ����_________������ȡ����ȡ�����Ӧ��
�ڷ������ݿ�֪������ʺϴ��ģģ������̵���ԭ��_________��
�۴�ƽ���ӽǿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��____________��
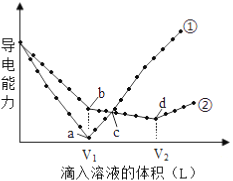
��2����ҵ�̵���Ӧ�У�������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ��p1��p2�������¶ȱ仯�����ߣ���ͼ��ʾ��ͼʾ�У���ȷ����_______���A����B�������Ƚ�p1��p2�Ĵ�С��ϵ________������____________��

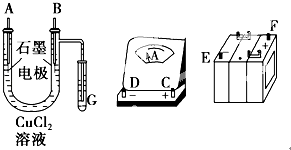
��3��20����ĩ����ѧ�Ҳ��ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ�ָ��³�ѹ�µĵ绯ѧ�ϳɰ�������˷�Ӧ���ת���ʣ���ʵ���ͼ��C��ʾ�������ĵ缫��Ӧʽ��___________��
��4�����꣬���п�ѧ������ڳ��¡���ѹ�������������ºϳɰ�������˼·����Ӧԭ��Ϊ��2N2��g��+6H2O��l��![]() 4NH3��g��+3O2��g�������䷴Ӧ�ȡ�H=__________������֪��N2��g��+3H2��g��
4NH3��g��+3O2��g�������䷴Ӧ�ȡ�H=__________������֪��N2��g��+3H2��g��![]() 2NH3��g�� ��H=-92.4kJ��mol-1��2H2��g��+O2��g��
2NH3��g�� ��H=-92.4kJ��mol-1��2H2��g��+O2��g��![]() 2H2O��l�� ��H=-571.6kJ��mol-1��
2H2O��l�� ��H=-571.6kJ��mol-1��
���𰸡� ���� KֵС��������еij̶�С����ת���ʵͣ������ʺϴ��ģ����������������غ��������۷֣������ֵ��ǻ��㲿�֣� ����Ӧ�����Ƕȿ��ǣ����¸��ã����Ӵ������Ե��ۺ����ؿ���ѡ��500�����Һ��ʣ�û�д���������Եģ����۷֣� A p2>p1 ����������ͬʱ����Ӧ��������������������ٵģ�ѹǿ�����ڰ��������ɣ���p2��N2ת���ʸ� N2+6e-+6H+===2NH3 +1530 kJ��mol-1
��������������������⿼���˹���ɵ�Ӧ�ã���ѧƽ�ⳣ����Ӧ�ú�Ӱ�컯ѧƽ�ⳣ�������أ���ѧƽ��ͼ��ķ����������е缫��Ӧʽ����д��
��1���������̵���Ӧ���¶����ߣ���ѧƽ�ⳣ�����������¶�ƽ��������Ӧ�����ƶ�������ӦΪ���ȷ�Ӧ�������̵���Ӧ�������ȷ�Ӧ��
��������˴��ģģ������̵���ԭ���ǣ������̵��Ļ�ѧƽ�ⳣ��С����Ӧ������еij̶�С����Ӧ���ת���ʵ���
����ҵ�̵������¶�Kֵ��С�������¶�ƽ�����淴Ӧ�����ƶ�����ҵ�̵�����ӦΪ���ȷ�Ӧ��ʹ�ó�������߷�Ӧ���ת���ʣ�����Ӧ����С��ʵ�ʹ�ҵ������ѡ��500�����ҵĸ��µ�ԭ���ǣ��ӷ�Ӧ���ʽǶȿ��ǣ����¸�����500��ʱ�����Ļ�����ߡ�
��2����ҵ�̵������¶�Kֵ��С�������¶�ƽ�����淴Ӧ�����ƶ���N2��ת���ʼ�С����ȷ��ͼʾΪA����ͼA�ĺ���������ȡһ����������Ĵ�ֱ���������ཻ����ͼ�ɼ�����ͬ�¶���p2ʱN2��ת���ʴ���p1ʱN2��ת��������ҵ�̵�������Ӧ�������������С�ķ�Ӧ������ѹǿƽ��������Ӧ�����ƶ���N2��ת����������p2![]() p1��
p1��
��3���ϳɰ��ķ�ӦΪN2+3H2![]() 2NH3��N2�����õ��ӵĻ�ԭ��Ӧ��H2����ʧ���ӵ�������Ӧ���������缫��ӦʽΪH2-2e-=2H+�������缫��ӦʽΪN2+6e-+6H+=2NH3��
2NH3��N2�����õ��ӵĻ�ԭ��Ӧ��H2����ʧ���ӵ�������Ӧ���������缫��ӦʽΪH2-2e-=2H+�������缫��ӦʽΪN2+6e-+6H+=2NH3��
��4������Ӧ��ţ�N2��g��+3H2��g��![]() 2NH3��g�� ��H=-92.4kJ��mol-1����ʽ��
2NH3��g�� ��H=-92.4kJ��mol-1����ʽ��
2H2��g��+O2��g��=2H2O��l�� ��H=-571.6kJ��mol-1����ʽ��
Ӧ�ø�˹���ɣ���ʽ![]() 2-��ʽ
2-��ʽ![]() 3��2N2��g��+6H2O��l��
3��2N2��g��+6H2O��l��![]() 4NH3��g��+3O2��g����H=��-92.4kJ/mol��
4NH3��g��+3O2��g����H=��-92.4kJ/mol��![]() 2-��-571.6kJ/mol��
2-��-571.6kJ/mol��![]() 3=+1530kJ/mol��
3=+1530kJ/mol��

����Ŀ��ȼ�ϵ����һ������Դ������2CO+O 2 �T2CO 2 ���ȼ�ϵ��ʱ������������Ӧ�������� �� ����������Ӧ�������� ��
����Ŀ����ȥ���������е�����,�����Լ��ͷ�����ȷ���ǣ� ��
ѡ�� | ���� | ���� | �����������Լ��ͷ��� |
A | KCl��Һ | I2 | ���� |
B | KNO3 | K2SO4 | BaCl2��Һ������ |
C | Cu | CuO | ϡ���ᣬ���� |
D | CaCO3 | Ca(OH)2 | ���ᣬ���� |
A. A B. B C. C D. D
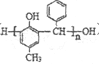
����Ŀ�������ﺣ���к�������ḻ���ṹ��ӱ�Ĵ�����л����Ǻ��������������ʵ���Ҫ��Դ֮һ��һ�ִӺ�������ȡ���п��������Ե���Ȼ������������£�
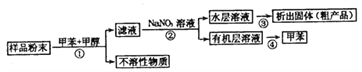
���й��ڸ������и������˵���У�������ǣ� ��
ѡ�� | ���� | ����װ�� | ��Ҫ���� |
A | �� | ����װ�� | ©�� |
B | �� | ��Һװ�� | ��Һ©�� |
C | �� | ����װ�� | ���� |
D | �� | ����װ�� | ������ƿ |
A. A B. B C. C D. D