题目内容
根据下列实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
C
解析试题分析:A、向等浓度且较稀的NaCl、KI混合液中滴加AgNO3溶液,先出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI),正确;B、向溶液x中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸变蓝,原溶液中有NH4+,正确;C、溴乙烷与NaOH溶液共热后,加入AgNO3溶液 未出现淡黄色沉淀,原因是未加稀硝酸中和过量的氢氧化钠溶液,错误;D、将SO2通入溴水中,溴水褪色,说明SO2具有还原性,正确。
考点:考查实验方案的分析、评价。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
实验室制乙烯时,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。
实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯, 加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| …… | |
| 实验完毕, 清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(2)溶液“渐渐变黑”,说明浓硫酸具有 性。
(3)分析使B中溶液褪色的物质,甲认为是C2H4,乙认为不能排除SO2的作用。
① 根据甲的观点,使B中溶液褪色反应的化学方程式是 。
② 乙根据现象Ⅲ认为产生了SO2,在B中与SO2反应使溶液褪色的物质是 。
③ 为证实各自观点,甲、乙重新实验,设计与现象如下:
| | 设 计 | 现 象 |
| 甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | Br2的CCl4溶液褪色 |
| 乙 | 与A连接的装置如下: | D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
b. 根据乙的设计,C中盛放的试剂是___ __。
c. 能说明确实是SO2使E中溶液褪色的实验是_ ___。
d. 乙为进一步验证其观点,取少量D中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是____ _。
(4)上述实验得到的结论是 。
关于图中各装置的叙述不正确的是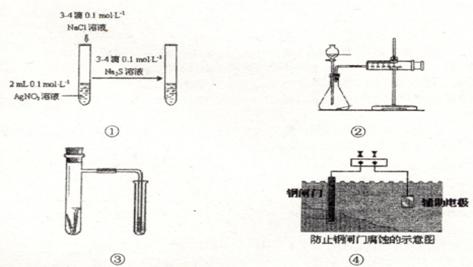
| A.装置①能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
| B.装置②能测量锌与硫酸的反应速率 |
| C.装置③能验证铁的吸氧腐蚀 |
| D.装置④的X电极是负极,则能验证外接电源的阴极保护法 |
下列实验操作正确且能达到预期目的的是
| | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C | 确定碳、氯两元素非金属性的强弱 | 测定同温同浓度的Na2CO3和NaClO水溶液的pH |
| D | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
以下实验目的能达到的是( )
| A.测Zn的相对原子质量可以通过测Zn的质量以及这些Zn和过量的稀硫酸反应时放出H2的体积 |
| B.测Na2CO3、NaHCO3混合物中Na2CO3的质量分数可以通过测样品的质量及样品和过量Ba(OH)2溶液反应的沉淀的质量 |
| C.测中和热时,可以用稀氨水代替NaOH溶液 |
| D.将淀粉溶液滴入某混合液中,检验是否含有碘化钾 |





