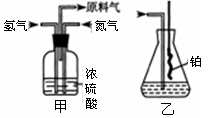
题目内容
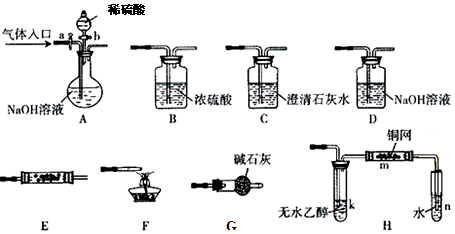
利用如图装置探究氯气和氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:
(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): 。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:
(15分)(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
(3)(见右图) (3分)
(3分)
(4)3Cl2+8NH3=6NH4Cl+N2;3∶2 (各2分);取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀 (2分)
(5)将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中(1分)
解析试题分析:(1)F装置是制备氯气的,浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)装置A是制备氨气的,氨水中存在电离平衡NH3·H2O NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应该选择饱和食盐水;水蒸气常用浓硫酸除去,因此正确的连接是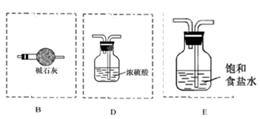 。
。
(4)在C中观察到大量白烟,同时产生一种气体单质,白烟应该是氯化铵,单质应该是氮气。这说明氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,反应的化学方程式是8NH3+3C12=6NH4C1+N2;根据方程式可知,氮元素的化合价从-3价升高到0价,氯元素的化合价从0价降低到-1价,所以根据电子的得失守恒可知,反应中氧化剂与还原剂的物质的量比为3∶2;氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+。
(5)氯气属于大气污染物,需要尾气处理,正确的的操作应该是将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中。
考点:考查氯气和氨气的制备;气体的净化与尾气处理;离子的检验以及氧化还原反应方程式的书写和计算等

实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为:_ ;为了吸收该反应中产生的尾气,应选择下列装置(填字母)。
(2)为符合绿色化学的要求,某研究性学习小组设计了如下两种方案:
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通人到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp(Cu(OH)2]=10-22, Ksp[Fe(OH)2]=10-16,Ksp[Fe(OH)3]=10-38
请回答下列问题:
①方案1中的B仪器名称是_。
②为了使铁元素全部沉淀,应调节pH至少为_。
③方案2中甲物质可选用的是_。
| A.CaO | B.NaOH | C.CuCO3 | D.Cu2(OH)2CO3 E. Fe2(SO4)3 |
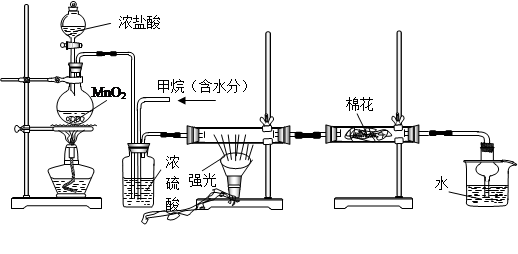
氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,仅铁架台和夹持仪器已略去。
部分物质的有关物理数据如下:
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
试回答:
(1)A中深色固体与无色液体制备气体的离子方程式: 。
(2)B中盛有液体c是饱和 ,C中的液体d是浓硫酸。?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是
(在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的 。
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无 管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而 。
根据下列实验操作和现象所得出的结论不正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向等浓度且较稀的NaCl、KI混合 液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 向溶液x中滴加浓NaOH溶液, 将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| C | 溴乙烷与NaOH溶液共热后,加入 AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有发生水解 |
| D | 将SO2通入溴水中 | 溴水褪色 | SO2具有还原性 |
下列有关实验现象和解释或结论都正确的选项是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的ΔH<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀 变为黄色 | 溶度积:AgI比 AgCl更小 |