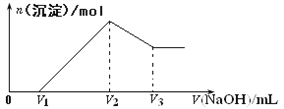
题目内容
【题目】A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,B的单质在空气中含量最多,C、D元素同主族且原子序数D为C的二倍,E元素的价电子排布式为(n﹣l)d10+6ns1 , 回答下列问题:
(1)元素B在周期表中的位置是 .
(2)D元素基态原子的外围电子排布式为 .
(3)BC ![]() 的立体构型为 .
的立体构型为 .
(4)A元素与C元素形成两种常见的化合物,其原子个数比分别为2:1和1:1,两种化合物可以任意比互溶,原因是;其中一种化合物可在酸性条件下将KMnO4还原为Mn2+ , 写出相关反应的离子方程式:
(5)将过量BA3气体通入含E2+溶液中充分反应后生成的二价阳离子是(填离子符号),Imol该离子中含σ键为mol.
【答案】
(1)第二周期ⅤA族
(2)3S23P4
(3)平面三角形
(4)2MnO ![]() +5H2O2+6H+=2Mn2++5O2↑+8H2O
+5H2O2+6H+=2Mn2++5O2↑+8H2O
(5)[Cu(NH3)4]2+;16
【解析】解:A、B、C、D、E五种元素的原子序数依次增大,A原子无中子,则A为H元素;B的单质在空气中含量最多,则B为N则C为O元素、D为S元素;E元素的外围电子排布为(n﹣l)dn+6nsl , 则n+6=10,故n=4,故其外围电子排布为3d104sl , 则E为Cu;(1)B为N元素,处于周期表中第二周期VA族,所以答案是:第二周期VA族;(2)D为S,原子核外有16个电子,分3层排布,其电子排布式为1S22S22P63S23P4 , 所以基态原子的外围电子排布式为3S23P4;所以答案是:3S23P4;(3)NO3﹣的中心原子N的价层电子对数=3+ ![]() (5+1﹣3×2)=3,没有孤电子对,所以立体构型为平面三角型;所以答案是:平面三角型;(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2 , 由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶;过氧化氢能被酸性高锰酸钾氧化生成氧气,其反应的离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;所以答案是:H2O与H2O2之间形成氢键;2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;(5)NH3与Cu2+通过配位键结合形成配离子[Cu(NH3)4]2+;[Cu(NH3)4]2+中共价键数目为12,配位键的数目为4,所以1mol该离子中含σ键为16mol;所以答案是:[Cu(NH3)4]2+;16.
(5+1﹣3×2)=3,没有孤电子对,所以立体构型为平面三角型;所以答案是:平面三角型;(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,分别为H2O与H2O2 , 由于H2O与H2O2之间形成氢键,两种化合物可任意比互溶;过氧化氢能被酸性高锰酸钾氧化生成氧气,其反应的离子方程式为:2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;所以答案是:H2O与H2O2之间形成氢键;2MnO4﹣+5H2O2+6H+=2Mn2++5O2↑+8H2O;(5)NH3与Cu2+通过配位键结合形成配离子[Cu(NH3)4]2+;[Cu(NH3)4]2+中共价键数目为12,配位键的数目为4,所以1mol该离子中含σ键为16mol;所以答案是:[Cu(NH3)4]2+;16.