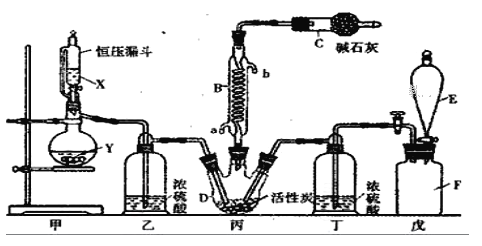
题目内容
【题目】硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______ ![]() ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu ![]() Cu(NO3)2
Cu(NO3)2
B.Cu ![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C.Cu ![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2 ![]() Cu(NO3)2
Cu(NO3)2
D.Cu![]() CuSO4
CuSO4 ![]() Cu(NO3)2
Cu(NO3)2
【答案】(1)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O;(2)Cu;得到, 1 ;(3)C ;
(4)HNO3+FeSO4 → Fe(NO3)3+Fe2(SO4)3+N2O↑+H2O 8Fe2++2NO3-+10H+ = 8Fe3++N2O↑+5H2O
(5)B
【解析】
试题分析:(1)Cu与浓HNO3反应生成硝酸铜、二氧化氮和水,化学方程式为:Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O;(2)该反应中铜元素的化合价升高,发生氧化反应,硝酸中氮元素的化合价由+5价降为+4,作氧化剂,1 mol氧化剂得到1mol电子;(3)铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,则n(NO2)+n(NO)=1mol,即被还原的硝酸的物质的量为1mol,48.0 g Cu的物质的量为0.75mol,则生成n(Cu(NO3)2)=0.75mol,可知表现酸性的硝酸的物质的量为0.75mol×2=1.5mol,则:参加反应的硝酸的物质的量为:1mol+1.5mol=2.5mol,选C。(4)所给的物质中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,能将还原性的FeSO4氧化为Fe2(SO4)3 、Fe(NO3)3,故发生的反应为HNO3+FeSO4 → Fe(NO3)3+Fe2(SO4)3+N2O↑+H2O;根据离子方程式的书写原则及氧化还原方程式配平原则写出配平后的离子方程式:8Fe2++2NO3-+10H+ = 8Fe3++N2O↑+5H2O ;(5) A、铜与硝酸反应会产生一氧化氮、二氧化氮等大气污染物,错误;B、该途径符合绿色化学原理,正确;C、该流程中氧化铜与水不反应,不能制得硝酸铜,错误;D、该途径中铜与稀硫酸不反应,不能制得硫酸铜;铜与浓硫酸反应会产生二氧化硫气体,污染大气,错误,选B。

【题目】同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.6kJ/mol.测得数据如表
2NH3(g) △H=-92.6kJ/mol.测得数据如表
容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
(1) | 2 | 3 | 0 | 27.78kJ |
(2) | 1.6 | 1.8 | 0.8 | Q |
下列叙述不正确的是
A.容器(1)(2)反应达平衡时压强相等
B.容器(2)中反应开始时v(正)>v(逆)
C.容器(2)中反应达平衡时,吸收的热量Q为9.26kJ
D.若条件为“绝热恒容”,容器(1)中反应达平衡时n(NH3)<0.6mol