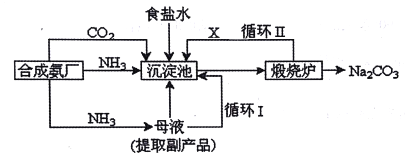
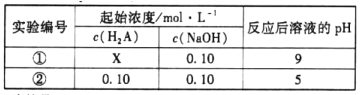
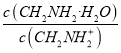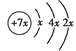题目内容
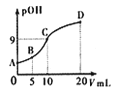
【题目】将物质的量相等的A、B混合加入2 L的密闭容器中,发生如下反应:3A(气)+B(气) ![]() xC(气)+2D(气)。经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·(L·min)-1。回答下列问题:
xC(气)+2D(气)。经5 min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol·(L·min)-1。回答下列问题:
(1)x值是____________。
(2)用B表示5 min内的平均反应速率为__________。
(3)反应开始前加入容器中的A、B的物质的量分别为________。
【答案】 2 0.05 mol·(L·min)-1 3 mol、3 mol
【解析】试题分析:利用“三段式”计算。
解析:设开始加入A、B的物质的量分别为a mol; C的平均反应速率是0.1 mol·(L·min)-1, 5 min末C的浓度是 0.1 mol·(L·min)-1×5=0.5 mol·L-1;

则(0.5a-0.75):( 0.5a-0.25)=3:5
A=3
根据系数比等于变化量比, ![]() ,x=2;
,x=2; ![]() 0.05 mol·(L·min)-1。
0.05 mol·(L·min)-1。

【题目】下图是不完整的元素周期表。A~H八种元素的位置已确定,完成下列各题。
A | |||||||||||||||||
B | C | D | |||||||||||||||
E | F | G | |||||||||||||||
H | |||||||||||||||||
(1)用实线画出元素周期表的上边界。用阴影表示出非金属元素。(请用黑色水笔书写)__________
(2)用一个置换反应证明F和G的非金属性强弱:(书写离子方程式)_____________。
(3)已知A和C能形成含有18个电子的化合物,其含有的化学键的类型为__________、__________。
(4)已知A和C也能形成CA5的离子化合物,请书写其电子式__________________。
(5)H能与C的最高价氧化物对应的水化物的稀溶液反应,写出反应的离子方程式________________。
(6)判断B的氢化物和E的氢化物的沸点高低:BHm_____________EHm(填“大于”、“等于”或“小于”)。
(7)C的氢化物极易溶于D的氢化物的原因是_____________________________。