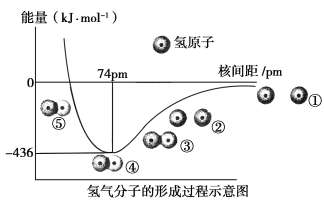
题目内容
【题目】25℃时,将不同浓度的二元弱酸H2A和NaOH溶液等体积混合(体积变化忽略不计),设计反应后溶液的pH如下表:
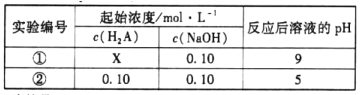
下列判断不正确的是
A.X<0.1
B.HA-的电离程度大于水解程度
C.将实验①所得溶液加水稀释后,c(A2-)/c(HA-)变大
D.实验②所得溶液:c(Na+)=c(A2-)+c(HA-)+c(H2A)
【答案】C
【解析】
试题分析:A、根据实验②,X不能等于0.1,溶液会显酸性,不符合题意,如果X>0.1,则H2A过量,溶液仍然显酸性,所以X<0.1溶液才会显碱性,说法正确;B、根据实验②所给的数据,反应后溶质是NaHA,溶液显酸性,说明HA-的电离程度大于水解,说法正确;C、加水稀释,促使盐类水解,n(A2-)减小,n(HA-)增大,所以比值是减小,说法错误;D、实验②反应后的溶质是NaHA,根据物料守恒:c(Na+)=c(A2-)+c(HA-)+c(H2A),说法正确;故答案选C。

练习册系列答案
相关题目