题目内容
【题目】我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
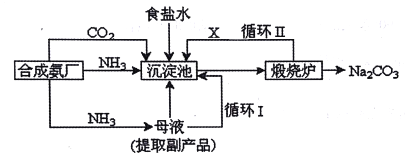
(1)沉淀池中发生的化学反应方程式是______。
(2)上述流程中X物质的分子式______。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(选填字母)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(4)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

请回答:
①甲中发生反应的离子方程式是________。
②乙装置中的试剂是___________。
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
④为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入___气体,再从b管通入_____ 气体。
⑤装置c中的试剂为_______(选填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)请你再写出一种实验室制取少量碳酸氢钠的方法:(用简要的文字和相关的化学反应方程式来描述):________________。
【答案】 NH3+H2O+CO2+NaCl=+NaHCO3↓或NH3+H2O+CO2=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl CO2 c CaCO3+2H+=Ca2++CO2↑+H2O 饱和NaHCO3溶液 过滤 NH3 CO2 C 用碳酸氢铵与适量饱和食盐水反应:NH4HCO3+NaCl=NaHCO3↓+NH4Cl(或向NaOH溶液中通入过量CO2:NaOH+CO2=NaHCO3;向饱和Na2CO3溶液中通入过量CO2:Na2CO3+CO2+H2O=2NaHCO3等。其他合理方法均可)
【解析】(1)沉淀池中氨气、二氧化碳、氯化钠溶液发生反应生成碳酸氢钠和氯化铵,反应的化学反应方程式是NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;(2)碳酸氢钠分解生成碳酸钠、水和CO2,所以上述流程中X物质的分子式为CO2;(3)由于碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出,答案选C;(4)①甲中制备CO2,发生反应的离子方程式是CaCO3+2H+=Ca2++CO2↑+H2O;②生成的CO2中含有氯化氢,需要除去,则乙装置中的试剂是饱和NaHCO3溶液;③实验结束后,分离出NaHCO3晶体的操作是过滤;④由于CO2在水溶液中的溶解度较小,而氨气极易溶于水,所以为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入NH3气体(防止倒吸),再从b管通入CO2气体;⑤装置c是干燥管,不能盛放溶液,碱石灰能吸收CO2,所以c中的试剂为无水氯化钙,答案选C;(5)实验室制取少量碳酸氢钠的方法可以用碳酸氢铵与适量饱和食盐水反应:NH4HCO3+NaCl=NaHCO3↓+NH4Cl(或向NaOH溶液中通入过量CO2:NaOH+CO2=NaHCO3;向饱和Na2CO3溶液中通入过量CO2:Na2CO3+CO2+H2O=2NaHCO3等)。