题目内容
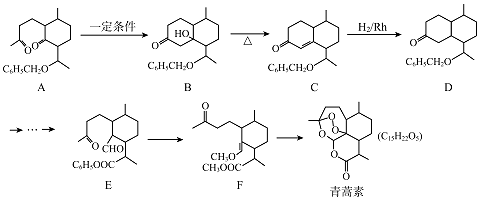
【题目】用0.1molL﹣1的盐酸滴定25.00mLNa2CO3溶液,其滴定曲线如图所示,下列说法正确的是( ) 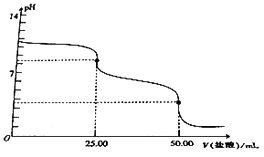
A.Na2CO3溶液的浓度为0.2molL﹣1
B.当V(盐酸)=0时,溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.当V(盐酸)=25.00mL时,溶液中:c(Cl﹣)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3)
D.当V(盐酸)=50.00mL时,溶液中:c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)
【答案】B
【解析】解:A.用0.1molL﹣1的盐酸滴定25.00mLNa2CO3溶液,当消耗V(HCl)=25.00mL时,溶液的pH发生急剧变化,说明此时二者恰好完全反应,二者物质的量以1:1反应,二者的体积相,则浓度相等,所以碳酸钠溶液浓度为0.1mol/L,故A错误;B.当盐酸体积为0时,溶液中溶质为碳酸钠,存在质子守恒,根据质子守恒得c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3),故B正确;
C.当V(盐酸)=25.00mL时,溶液中溶质为等物质的量浓度的碳酸氢钠和氯化钠,碳酸氢根离子水解导致溶液呈碱性,但其水解程度较小,其水解程度大于电离程度,所以c(CO32﹣)<c(H2CO3),故C错误;
D.当V(盐酸)=50.00mL时,二者恰好完全反应生成氯化铵、碳酸,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH﹣)+c(Cl﹣)+(HCO3﹣)+2c(CO32﹣),故D错误;
故选B.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目