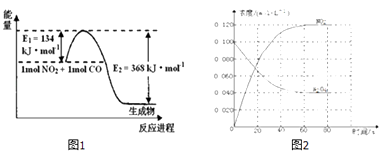
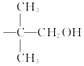��Ŀ����
����Ŀ��������H������ң����ٴ����õ���ʹ����ҩ����ϳ�·�����£����ַ�Ӧ�������Լ��ԣ���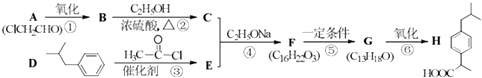
��֪����i�� ![]() ��R1��R2���������
��R1��R2���������
��ii�� ![]() +ClCH2COOR4+R4ONa��
+ClCH2COOR4+R4ONa�� ![]() COOR4+R4OH+NaCl��R3��R4���������
COOR4+R4OH+NaCl��R3��R4���������
��ش��������⣺
��1��������H�ķ���ʽ�� �� ������B�Ĺ����������� �� �ڢ۲��Ļ�ѧ��Ӧ������ ��
��2���ڢڲ���Ӧ�Ļ�ѧ����ʽ�� ��
��3��������G�Ľṹ��ʽ�� ��
��4���ڢܲ���Ӧ�Ļ�ѧ����ʽ�� ��
��5��ͬʱ��������������H������ͬ���칹��Ľṹ��ʽ�� ��
I���ṹ���б������ީ�O��O����II���˴Ź�������Ϊ4��壬�����֮��Ϊ2��2��1��1��
���𰸡�
��1��C13H18O2���Ȼ�����ԭ�ӣ�ȡ����Ӧ
��2��![]()
��3��![]()
��4��![]()
��5��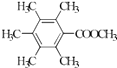 ��
�� 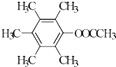 ��
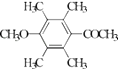
�� 
���������⣺A��������BΪClCH2COOH��B���Ҵ�����������Ӧ����CΪClCH2COOC2H5 �� D��CH3COCl����ȡ����Ӧ����EΪ ![]() ��E��C������Ϣ��2���еķ�Ӧ����FΪ
��E��C������Ϣ��2���еķ�Ӧ����FΪ ![]() ���Ա�F��G�ķ���ʽ��H�Ľṹ��֪GΪ
���Ա�F��G�ķ���ʽ��H�Ľṹ��֪GΪ ![]() ��G����������Ӧ����H����1��������H�ķ���ʽ�ǣ�C13H18O2 �� BΪClCH2COOH��������B�Ĺ�����Ϊ�Ȼ�����ԭ�ӣ��ڢ۲��Ļ�ѧ��Ӧ������ȡ����Ӧ��
��G����������Ӧ����H����1��������H�ķ���ʽ�ǣ�C13H18O2 �� BΪClCH2COOH��������B�Ĺ�����Ϊ�Ȼ�����ԭ�ӣ��ڢ۲��Ļ�ѧ��Ӧ������ȡ����Ӧ��
�ʴ�Ϊ��C13H18O2���Ȼ�����ԭ�ӣ�ȡ����Ӧ����2���ڢڲ���Ӧ�Ļ�ѧ����ʽ�ǣ� ![]() ��
��
�ʴ�Ϊ�� ![]() ����3��������G�Ľṹ��ʽ�ǣ�
����3��������G�Ľṹ��ʽ�ǣ� ![]() ��
��
�ʴ�Ϊ�� ![]() ����4���ڢܲ���Ӧ�Ļ�ѧ����ʽ�ǣ�
����4���ڢܲ���Ӧ�Ļ�ѧ����ʽ�ǣ� ![]() ��
��
�ʴ�Ϊ�� ![]() ����5��H��ͬ���칹�����㣺I���ṹ���б������ީ�O��O����II���˴Ź�������Ϊ4��壬�����֮��Ϊ2��2��1��1������������ͬ���칹���У�
����5��H��ͬ���칹�����㣺I���ṹ���б������ީ�O��O����II���˴Ź�������Ϊ4��壬�����֮��Ϊ2��2��1��1������������ͬ���칹���У� 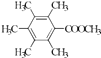 ��
�� 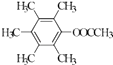 ��
�� 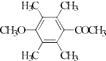 ��
��
�ʴ�Ϊ�� 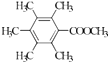 ��
�� 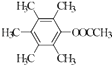 ��
�� 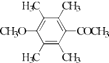 ��
��
A��������BΪClCH2COOH��B���Ҵ�����������Ӧ����CΪClCH2COOC2H5 �� D��CH3COCl����ȡ����Ӧ����EΪ ![]() ��E��C������Ϣ��2���еķ�Ӧ����FΪ
��E��C������Ϣ��2���еķ�Ӧ����FΪ ![]() ���Ա�F��G�ķ���ʽ��H�Ľṹ��֪GΪ
���Ա�F��G�ķ���ʽ��H�Ľṹ��֪GΪ ![]() ��G����������Ӧ����H��
��G����������Ӧ����H��

����Ŀ������������
��1��Fe3+���������ԣ�ʵ���Ҳⶨ�����Һ��I���ĺ����Ĺ������£���ȡ25.00mL��Һ��250mL��ƿ�У��ֱ����5mL 2molL��1 H2SO4��10mL 20% Fe2��SO4��3��Һ��ҡ�ȣ�С���������������ȫ������ȡ����ƿ��ȴ���뼸�ζ����������ƣ�����ָʾ��������0.02500molL��1��K2Cr2O7��Һ���еζ����յ㣮�ظ�3�Σ����ݼ�¼�����
���� | 1 | 2 | 3 |
����/mL | 19.98 | 20.02 | 19.00 |
��i����ʢ�з�Һ����ƿ���ȼ���5mL 2molL��1 H2SO4��Ŀ���� �� �������ӷ���ʽ�������������ͣ�
��ii�������������漰�ķ�Ӧ����2Fe3++2I���T2Fe2++I2�� ��
��iii�����ݵζ��й����ݣ��÷�Һ��I��������gL��1 ��
��iv���ڵζ������У����в���������������ȷ������ɲⶨ���ƫ�͵��� ��
A���յ����ʱ���Ӷ������ζ�ǰƽ�Ӷ���
B����ƿˮϴ�º�δ����
C���ζ���δ�ñ�K2Cr2O7��Һ��ϴ
D��ʢ��K2Cr2O7��Һ�ĵζ��ܣ��ζ�ǰ�����ݣ��ζ��������ݣ�
��2��Fe3+��Ag+�����������ǿ��һֱ��ʵ��̽�����ȵ㣮ijѧϰС��ͬѧ�������ʵ�飺
ʵ���� | ʵ����� | ���� |
1 | ��10mL 3mol/L KNO3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ | �ް�ɫ�������� |
2 | ��10mL 1mol/L AgNO3��Һ�еμ�2mL 0.1mol/L FeSO4��Һ�����ٵμ�����KMnO4��Һ | �Ϻ�ɫ����ȥ |
3 | ��10mL 1mol/L Fe��NO3��3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ | �а�ɫ�������� |
��ش�
��i�����ʵ��ٵ�Ŀ���� ��
��ii��ʵ��ۿɵó������� ��
��iii��д��ʵ����з�Ӧ�����ӷ���ʽ
��iv����������ʵ�飬Fe3+��Ag+�����������ǿ���������йأ�