题目内容
13.回答下列问题:(1)等温等压下,等体积的O2和O3所含氧原子个数比为2:3,质量比为2:3.
(2)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为5.4mL.
(3)8.4g氮气和9.6g某单质Rx所含原子个数相同,且分子个数之比为3:2,则R的相对原子质量是16,x的值是3.
分析 (1)等温等压下,等体积的O2和O3的物质的量相等,结合分子式计算含氧原子个数比,均由氧原子构成,二者质量之比等于氧原子数目之比;
(2)根据c=$\frac{1000ρω}{M}$计算浓硫酸物质的量浓度,再根据稀释定律计算需要浓硫酸体积;
(3)结合分子数之比与原子数目相等计算x的值,根据n=$\frac{m}{M}$计算氮气物质的量,结合分子数目之比计算单质Rx的物质的量,再根据M=$\frac{m}{n}$计算Rx的摩尔质量,进而计算R的相对分子质量.
解答 解:(1)等温等压下,等体积的O2和O3的物质的量相等,则二者含氧原子个数比为2:3,均由氧原子构成,二者质量之比等于氧原子数目之比,及二者质量之比为2:3,
故答案为:2:3;2:3;
(2)根据c=$\frac{1000ρω}{M}$可知,密度为1.84g•mL-1、质量分数为98%的浓硫酸物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,根据稀释定律,需要浓硫酸体积为$\frac{100mL×1mol/L}{18.4mol/L}$=5.4mL,
故答案为:5.4;
(3)8.4g氮气和9.6g某单质Rx所含原子个数相同,且分子个数之比为3:2,则3×2=2x,故x=3,氮气物质的量为$\frac{8.4g}{28g/mol}$=0.3mol,则单质Rx的物质的量为0.3mol×$\frac{2}{3}$=0.2mol,Rx的摩尔质量为$\frac{9.6g}{0.2mol}$=48g/mol,则R的相对分子质量为$\frac{48}{3}$=16,
故答案为:16;3.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
3.密闭容器中进行的反应SO2(g)+O3(g)?SO3(g)+O2(g)温度保持不变,下列说法中正确的是( )
| A. | 增加SO2的浓度,正反应速率先增大,后逐渐减小最后保持不变 | |
| B. | 增加O2的浓度,正反应速率逐渐增大 | |
| C. | 增加SO2的浓度,平衡常数增大 | |
| D. | 若平衡时SO2的浓度比原来大,则平衡常数增大 |
4.能发生加成反应,也能发生取代反应,能使酸性高锰酸钾溶液褪色,同时也能使溴水因反应而褪色的( )
| A. | 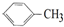 | B. | C6H12 | C. |  | D. | 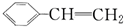 |
1.下列说法正确的是( )
| A. | 大量使用薪柴为燃料不能体现低碳生活 | |
| B. | 实现化石燃料清洁利用,就无需开发新能源 | |
| C. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| D. | 钢管与电源正极连接,钢管可被保护 |
18.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测不正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀4.3g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测不正确的是( )
| A. | K+一定存在 | B. | 100mL溶液中含0.01molCO32- | ||
| C. | Cl-可能存在 | D. | Ba2+和Cl-一定不存在 |
5.下列物质电离出的Cl-数目与2molNaCl电离出的Cl-数目相同的是( )
| A. | 1mol MgCl2 | B. | 2mol KClO3 | C. | 1 mol AlCl3 | D. | 1.5 mol CaCl2 |

