题目内容
【题目】氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,见光易分解,在潮湿空气中易被氧化,难溶于水。
(1)实验室保存新制CuCl晶体的方法是_________________。
(2)已知:Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
2CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则反应4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=____kJ/mol。
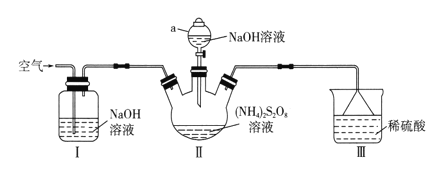
(3)利用CuCl难溶于水的性质,可以除去废水中的Cl-。向含Cl-的废水中同时加入Cu和CuSO4,溶液中平衡时相关离子浓度关系如图所示。[已知:pc(离子)=-lgc(离子)]

①除去废水中Cl-的离子方程式为_________________。
②Ksp(CuCl)=___________。
③已知:Cu+Cu2+![]() 2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
2Cu+ K=7.6×10-7。通过计算说明上述除Cl-的反应能完全进行的原因______________________________。
(4)T℃时,用H2还原CuCl制备活性铜:H2(g)+2CuCl(s)![]() 2Cu(s)+2HCl(g),达到平衡时,H2的转化率(
2Cu(s)+2HCl(g),达到平衡时,H2的转化率(![]() )为80%。反应速率v=v正-v逆=
)为80%。反应速率v=v正-v逆=![]() ,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当
,k正、k逆分别为正、逆反应速率常数,x为气体的物质的量分数。当![]() =60%时,
=60%时,![]() =________(保留1位小数)。
=________(保留1位小数)。
(5)CuCl溶于浓氨水的反应原理为CuCl+2NH3·H2O![]() [Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
[Cu(NH3)2]-+2H2O+Cl-,该反应控制温度为70~80℃,其原因是_______________________。
【答案】干燥密封、避光保存 -177.6 Cu+Cu2++2Cl-=2CuCl 2×10-7 Kˊ=![]() =
=![]() =1.9×107,反应完全进行 3.2 温度过低,反应速率较慢;温度过高,NH3H2O分解
=1.9×107,反应完全进行 3.2 温度过低,反应速率较慢;温度过高,NH3H2O分解
【解析】
(1)根据CuCl见光易分解,在潮湿空气中易被氧化,难溶于水确定保存方法;
(2)根据盖斯定律,将方程式叠加,就可得到待求热化学方程式的反应热;
(3)①Cu、Cu2+发生氧化还原反应产生Cu+,Cu+与Cl-结合形成CuCl沉淀;
②Ksp(CuCl)=c(Cu+)c(Cl-),由pc(Cl-)=3.7及对应的p(Cu)计算;
③利用氧化还原反应的价态规律,即可写出Cu与Cu2+的反应,利用平衡常数及Ksp(CuCl)的大小与反应完全时的K的大小分析判断;
(4)先根据平衡时氢气的转化率为80%计算出![]() ,根据温度不变,
,根据温度不变,![]() ,然后将
,然后将![]() 再带入计算H2转化率为60%时的速率公式计算;
再带入计算H2转化率为60%时的速率公式计算;
(5)从化学反应速率和NH3·H2O的稳定性分析判断。
(1)由于CuCl难溶于水,在潮湿空气中易被氧化,见光易分解,所以在实验室保存新制CuCl晶体的方法是干燥密封、避光保存;
(2)由于物质含有的能量与反应途径无关,只与物质的始态和终态有关,所以①Cu(s)+Cl2(g)=CuCl2(s) △H1=-218.8kJ/mol
②2Cu(s)+O2(g)=2CuO(s) △H2=-310.6kJ/mol
③CuCl2(s)=2CuCl(s)+Cl2(g) △H3=+152.3kJ/mol
则②-①×2--③×2,整理可得:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)的△H=-177.6kJ/mol。
(3) ①在溶液中Cu、Cu2+、Cl-发生氧化还原反应,形成CuCl沉淀,反应的离子方程式为:Cu+Cu2++2Cl-=2CuCl;
②在pc(Cl-)=3.7点,c(Cl-)=2×10-4mol/L,pc(Cu+)=3,c(Cu+)=10-3 mol/L,由于Ksp(CuCl)=c(Cu+)c(Cl-)=1×10-3 mol/L×2×10-4mol/L=2×10-7mol2/L2;
③加入的单质铜具有还原性,而硫酸铜中二价铜具有氧化性,利用氧化还原反应与CuCl难溶于水即可除去氯离子,即Cu+Cu2++2Cl-=2CuCl;根据反应方程式可得平衡常数Kˊ=![]() =1.9×107,化学平衡常数的值大于105,所以反应可以完全进行;
=1.9×107,化学平衡常数的值大于105,所以反应可以完全进行;
(4)发生反应 H2(g)+2CuCl(s)![]() 2Cu(s)+2HC1(g),假设开始时氢气的物质的量为1mol,
2Cu(s)+2HC1(g),假设开始时氢气的物质的量为1mol,
n(开始) (mol) 1 0
n(平衡) (mol)0.2 2×0.8=1.6
x(H2)=![]() ,x(HCl)=
,x(HCl)=![]() ,反应达到平衡时,v(正)= v(逆),所以
,反应达到平衡时,v(正)= v(逆),所以![]() ,
,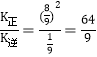 ;
;
发生该反应,假设开始时氢气的物质的量为1mol,H2转化率是60%
则 H2(g)+2CuCl(s)![]() 2Cu(s)+2HC1(g),
2Cu(s)+2HC1(g),
n(开始) (mol) 1 0
t时(mol) 0.4 2×0.6=1.2
x(H2)=![]() ,x(HCl)=
,x(HCl)=![]() ,
,![]() =
=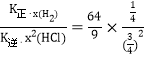 =
=![]() =3.2;
=3.2;
(5)该反应控制温度为70~80℃,是由于温度过低,反应速率较慢,达到平衡所需要的时间很长;若温度过高,NH3H2O又会发生分解反应,不利用反应的正向进行。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
沸点(℃) | -252.8 | -146 | -103.7 | -47.4 | 80.10 | 110.63 | 4827 |

(1)甲试管中最终残留物是_____________。它有多种用途,如下列转化就可制取聚乙炔。写出反应②的化学方程式__________________________ 。
![]()
(2)乙中试管收集到的两种产品中,有一种能使酸性高锰酸钾溶液褪色的物质,该物质为__________。
(3)丙中锥形瓶观察到的现象_____________________________________。反应的化学方程式是__________________________、_________________________。
(4)经溴的四氯化碳溶液充分吸收,最后收集到的气体是______________。