题目内容
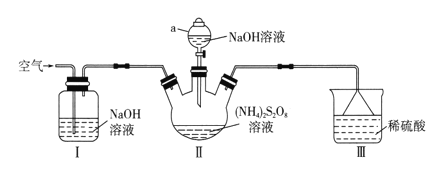
【题目】过硫酸钠(Na2S2O8)常用作漂白剂、氧化剂等。某研究小组利用下图装置制备Na2S2O8并探究其性质(加热及夹持仪器略去)。
已知:①(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3+2H2O
Na2S2O8+2NH3+2H2O
②2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
(1)仪器a的名称是________________。装置I中NaOH溶液的作用是___________。
(2)装置II发生反应的同时,需要持续通入空气的目的是_______________________。
(3)装置III的作用是__________________________。
(4)Na2S2O8溶液与铜反应只生成两种盐,且反应先慢后快。
①该反应的化学方程式为___________________________。
②某同学推测反应先慢后快的原因可能是生成的Cu2+对反应起催化作用。设计实验方案验证该推测是否正确___________。(供选试剂:Cu、Na2S2O8溶液、CuSO4溶液、Cu(NO3)2溶液、蒸馏水)
(5)测定产品纯度:称取0.2500g样品,用蒸馏水溶解,加入过量KI,充分反应后,再滴加几滴指示剂,用0.1000mol/LNa2S2O8标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为19.50mL。(已知:I2+2S2O32-=S4O62-+2I-)
①选用的指示剂是____________;达到滴定终点的现象是______________________。
②样品的纯度为___________%。
【答案】分液漏斗 吸收空气中的CO2 将三颈烧瓶中产生的NH3及时排出,减少副反应的发生 吸收NH3,防止倒吸 Na2S2O8+Cu=Na2SO4+CuSO4 向盛有等质量铜粉的试管中,分别加入等体积的硫酸铜溶液和蒸馏水,再加入等体积等浓度的Na2S2O8溶液,若加入硫酸铜溶液的试管中反应快,则该推断正确 淀粉溶液 滴入最后一滴标准溶液,溶液的蓝色褪去,且半分钟内不复原 92.82
【解析】
(1)根据仪器结构判断其名称;NaOH溶液为碱溶液,可吸收空气中的CO2气体;
(2)NaOH溶液与(NH4)2S2O8反应会产生氨气,装置II发生反应的同时,需要持续通入空气可将装置中的NH3驱赶出来;
(3)装置III中稀硫酸溶液可以吸收NH3,由于使用了倒扣漏斗,故可以防止倒吸现象的发生;
(4)①过硫酸钠(Na2S2O8)具有强的氧化性,将Cu氧化为Cu2+,S2O82-被还原为SO42-,根据电子守恒、原子守恒分析;
②若设计一个实验证明Cu2+对反应起催化作用,可采取对比实验,其中一个没有Cu2+,另外一个有Cu2+可确定设想的合理性;
(5)①根据I2遇淀粉溶液变为蓝色,选用淀粉溶液为指示剂,根据KI与Na2S2O8发生反应生成I2,I2与Na2S2O3反应测定,若反应完全,溶液中无I2,蓝色消失分析判断;
②根据Na2S2O8发生反应生成I2及Na2S2O3的物质的量关系,用关系式法计算该样品的纯度。
(1)根据仪器结构可知该仪器名称为分液漏斗;装置I中NaOH溶液的作用是吸收空气中的CO2,防止干扰实验;
(2)在装置II中NaOH溶液与(NH4)2S2O8反应会产生氨气,为防止污染环境,在装置II发生反应的同时,需要持续通入空气可将装置中的NH3及时排出,减少副反应的发生;
(3)装置III是稀硫酸溶液,大量溶解吸收NH3,由于使用了倒扣漏斗,因此使气体被充分吸收,同时也可以防止倒吸现象的发生;
(4)①过硫酸钠(Na2S2O8)具有强的氧化性,能将Cu氧化为Cu2+,S2O82-被还原为SO42-,根据电子守恒、原子守恒可得反应的方程式为:Na2S2O8+Cu=Na2SO4+CuSO4;
②设计实验证明Cu2+对反应起催化作用的实验方法是:采取对比实验,向盛有等质量铜粉的试管中,分别加入等体积的硫酸铜溶液和蒸馏水,再加入等体积等浓度的Na2S2O8溶液,若加入硫酸铜溶液的试管中反应快,则该推断正确,否则Cu2+没有催化作用,推断错误;
(5)①根据I2遇淀粉溶液变为蓝色,可选用淀粉溶液为指示剂,若滴定达到终点,会看到溶液由蓝色变为无色,半分钟内不再变为蓝色判断;
②Na2S2O8作氧化剂,1mol会得到2mol电子,KI被氧化变为I2,转移2mol电子,I2与Na2S2O3反应方程式为:I2+2Na2S2O3=Na2S4O6+2NaI,可得关系式:Na2S2O8—I2—2Na2S2O3,n(Na2S2O3)= 0.1000mol/L×19.50mL×10-3L/mL=1.95×10-3mol,则n(Na2S2O8)=![]() n(Na2S2O3)=9.75×10-4mol,m(Na2S2O8)= 9.75×10-4mol×238g/mol=0.23205g,则该样品的纯度为(0.23205g ÷0.2500g)×100%=92.82%。
n(Na2S2O3)=9.75×10-4mol,m(Na2S2O8)= 9.75×10-4mol×238g/mol=0.23205g,则该样品的纯度为(0.23205g ÷0.2500g)×100%=92.82%。

 计算高手系列答案
计算高手系列答案