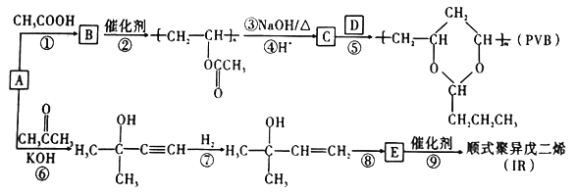
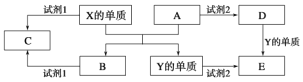
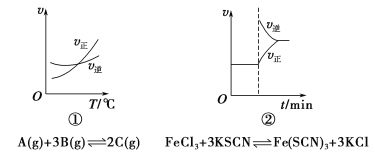
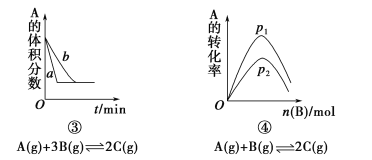
题目内容
【题目】化学与生产、生活、社会密切相关。下列有关说法正确的是
A. 点燃爆竹后,硫燃烧生成SO3
B. 中国古代利用明矾溶液的酸性清除铜镜表明的铜锈
C. 服用阿司匹林出现水杨酸反应时,用NaOH溶液解毒
D. 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力增强
【答案】B
【解析】A、S在空气中或纯氧燃烧都是SO2,故A错误;B、明矾中Al3+发生水解:Al3++3H2O ![]() Al(OH)3+3H+,溶液显酸性,铜锈是碱式碳酸铜,能与H+反应生成可溶于水的物质,故B正确;C、NaOH是强碱,对人体有伤害,因此水杨酸中毒,常常静脉滴注NaHCO3溶液,故C错误;D、肥皂的成分是高级脂肪酸钠,与Ca2+结合生成难溶于水的高级脂肪酸钙,肥皂的去污能力降低,故D错误。
Al(OH)3+3H+,溶液显酸性,铜锈是碱式碳酸铜,能与H+反应生成可溶于水的物质,故B正确;C、NaOH是强碱,对人体有伤害,因此水杨酸中毒,常常静脉滴注NaHCO3溶液,故C错误;D、肥皂的成分是高级脂肪酸钠,与Ca2+结合生成难溶于水的高级脂肪酸钙,肥皂的去污能力降低,故D错误。

练习册系列答案
相关题目