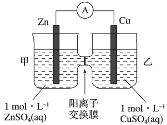
题目内容
【题目】2016年法国、美国和荷兰的三位化学家因“分子马达”方面的研究,获得诺贝尔化学奖。下面是其中一种光驱分子马达的结构,关于其结构的说法正确的是

A. 该分子的化学式为C22H44O2
B. 分子中最多有6个原子在一条直线上
C. lmol该分子最多可与8molH2发生反应
D. 该分子可以发生氧化、加成、酯化和水解反应
【答案】C
【解析】A.有机物的化学式为C34H44O2,A错误;B.与C≡C键直接相连接的原子在同一条直线上,包括两个苯环对角线的C、H原子,最多有8个原子在一条直线上,B错误;C.能与氢气发生加成反应的为2个苯环和碳碳三键,则1 mol该分子最多可与8 molH2发生反应,C正确;
D.含有碳碳三键和羧基,不能发生水解反应,D错误,答案选C。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目