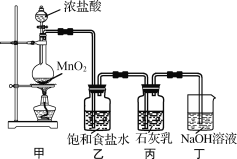
题目内容
【题目】海水化学资源的利用具有非常广阔的前景。以海水为原料制备MgCl2和NaOH的工艺流程如下:
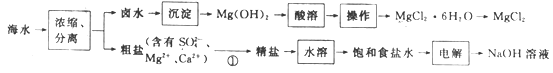
下列说法错误的是
A.“沉淀”时常用石灰乳作为沉淀剂
B.“酸溶”时加入过量盐酸,有利于得到MgCl2·6H2O晶体
C.“电解”时,NaOH在阴极区得到
D.过程①加入试剂的顺序依次为Na2CO3溶液、NaOH溶液、BaCl2溶液、稀盐酸
【答案】D
【解析】
A. 石灰乳廉价易得,故“沉淀”时常用石灰乳作为沉淀剂,A正确;
B. 镁离子易水解,故“酸溶”时加入过量盐酸,有利于得到MgCl2·6H2O晶体,B正确;
C. 电解饱和食盐水的氯碱工业,阴极由水电离出的氢离子放电,生成氢气,溶液中存在大量的氢氧根离子,与经阳离子交换膜移动来的钠离子形成NaOH溶液,C正确;
D. 为除去加入的过量的钡离子,应当将碳酸钠的加入顺序位于氯化钡之后,D错误;
故答案选D。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目