题目内容
7.质量为a g的铜丝,在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量仍为a g的是( )| A. | 乙醇 | B. | 盐酸 | C. | 一氧化碳 | D. | 硝酸 |
分析 铜丝灼烧成黑色.是生成了CuO:2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO,再结合CuO与选项中的物质发生的化学反应来分析判断.
解答 解:A、铜丝灼烧成黑色,立即放入乙醇中,CuO与乙醇反应:CuO+C2H5OH$\stackrel{△}{→}$CH3CHO+Cu+H2O,反应前后其质量不变,故A正确;
B、铜丝灼烧成黑色,立即放入盐酸中,CuO与盐酸反应,生成铜盐,质量减少,故B错误;
C、铜丝灼烧成黑色,立即放入一氧化碳中,氧化铜和一氧化碳发生氧化还原反应,生成二氧化碳和铜,铜的总质量不变,故C正确;
D、铜丝灼烧成黑色,立即放入硝酸中,CuO与硝反应,生成铜盐,质量减少,故D错误;
故选AC.
点评 本题主要考查了铜及其化合物的性质,难度不大,要注重过程的分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.当1mol某气态烃与2mol Cl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,所得产物再与2mol Cl2进行取代反应后,生成只含C、Cl两种元素的化合物.则该气态烃是( )
| A. | 乙烯 | B. | 乙炔 | C. | 丙烯 | D. | 丙炔 |
15.以下现象与核外电子的跃迁有关的是( )
①霓虹灯发出有色光;
②棱镜分光;
③激光器产生激光;
④石油蒸馏;
⑤凸透镜聚光;
⑥燃放的焰火,在夜空中呈现五彩缤纷;
⑦日光灯通电发光;
⑧冷却结晶;
⑨焰色反应.
①霓虹灯发出有色光;
②棱镜分光;
③激光器产生激光;
④石油蒸馏;
⑤凸透镜聚光;
⑥燃放的焰火,在夜空中呈现五彩缤纷;
⑦日光灯通电发光;
⑧冷却结晶;
⑨焰色反应.
| A. | ②④⑤⑧⑨ | B. | ①③⑥⑦⑨ | C. | ①③⑤⑥⑦ | D. | ①②③⑤⑥⑦ |
12.下列说法正确的是( )
| A. | 凡是卤代烃一定能发生消去反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| D. | 苯酚钠溶液中通入CO2生成苯酚,则碳酸的酸性比苯酚弱 |
19.下列物质中,各原子的最外层电子满足8电子稳定结构的分子是( )
| A. | CO2 | B. | N2O5 | C. | PCl5 | D. | NaCl |
16. 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
 重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂.工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7).制备装置如图所示(阳离子交换膜只允许阳离子透过). 制备原理:2CrO42-(黄色)+H+?Cr2O72-(橙色)+H2O.下列说法正确的是( )| A. | 电解时惰性电极应与直流电源的负极相连 | |
| B. | 通电后阴极室产生的现象为:产生无色气体,溶液由无色变黄色 | |
| C. | 制备过程中总的离子方程式为:2CrO42-+3H2O=Cr2O72-+2OH-+2H2↑+O2↑ | |
| D. | 若实验开始时在右室中加入38.8克的K2CrO4,tmin后测得右室中K与Cr的物质的量之比为3:2,此时电路中转移电子的物质的量为0.1mol |
17.有机化合物没食子茶素(EGC)结构简式如图所示.下列关于EGC的叙述中正确的是( )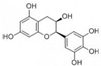

| A. | 分子中所有的原子共面 | |
| B. | 1mol EGC与4mol NaOH恰好完全反应 | |
| C. | 易发生氧化反应和取代反应,一定条件下可发生加成反应 | |
| D. | 易发生水解反应和显色反应,一定条件下可发生消去反应 |
 卤素的单质及其化合物在生产、生活中应用广泛.
卤素的单质及其化合物在生产、生活中应用广泛. (如${\;}_{1}^{2}$H).
(如${\;}_{1}^{2}$H).