题目内容
2.随着科学技术的发展,人们对石墨开发了许多新用途,广泛用于石油化工、原子能等工业领域.
(1)石墨的层状结构如图1所示,石墨中碳原子的杂化类型为sp2,图中7个六元环实际占有的碳原子数是14.
(2)由石墨可制石墨烯(如图2),下列有关石墨烯说法正确的是BD.
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
(3)石墨能与熔融金属钾作用,形成蓝色的C24K、灰色的C48K、C60K等.有一种青铜色的CxK中K原子(用o表示)的分布如图3所示,则x=8;另有一种石墨化合物C32K,其中K原子的分布也类似图的正六边形,该正六边形的边长是图中正六边形边长的2倍.
分析 (1)由图可知,每个碳原子形成3个共价键,则价层电子对数为3;每个六元环中含有6个碳原子,每个碳原子被三个环共用;
(2)A.石墨烯属于平面结构,金刚石属于立体结构;
B.石墨烯是一种平面结构;
C.根据一个碳原子含有的σ键判断12g石墨烯中含有的σ键个数;
D.根据石墨中层与层之间存在作用力分析.
(3)利用均摊法计算碳原子和钾原子个数之比,注意每个钾原子被几个三角形共用;从C8K变为C32K,C原子数扩大4倍,即图形面积扩大4倍,据此判断.
解答 解:(1)由图可知,每个碳原子形成3个共价键,则碳原子的价层电子对数为3,所以属于sp2杂化;每个六元环中含有6个碳原子,每个碳原子被三个环共用,则平均每个六元环含有2个碳原子,则7个六元环实际占有的碳原子数是14;
故答案为:sp2;14;
(2)A、石墨烯是平面结构,金刚石空间网状结构,故A错误;
B.碳碳双键上所有原子都处于同一平面,所以导致石墨烯分子中所有原子可以处于同一平面,故B正确;
C.石墨烯中一个碳原子形成三个共价键,每个共价键由两个碳原子构成,则一个碳原子具有1.5个σ键,所以12g石墨烯含σ键数为1.5NA,故C错误;
D.石墨结构中,石墨层与层之间存在分子间作用力,所以从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力,故D正确.
故答案为:BD;
(3)可以取三个钾原子形成的小三角形为计算单位,其完全占有的碳原子数是4,占有的钾原子数为$\frac{1}{6}$×3=$\frac{1}{2}$,故碳原子数和钾原子数之比是4:$\frac{1}{2}$=8:1,即x=8;
从C8K变为C32K,C原子数扩大4倍,即图形面积扩大4倍,则边长为原来的2倍,
故答案为:8;2.
点评 本题考查了物质结构与性质的知识,题目涉及杂化类型的判断、晶胞的计算等,难度中等,注意中心原子的杂化类型、均摊法在晶胞计算中的应用.

| A. | 硝基苯、苯、乙醇三种液体 | B. | 硫酸钠、硝酸钾、氯化钡三种固体 | ||
| C. | 硫磺、过氧化钠、氯化钙三种固体 | D. | 氯化铝、偏铝酸钠、烧碱三种固体 |
| A. | 10℃20 mL 3mol/L的X溶液 | B. | 20℃30 mL 2molL的X溶液 | ||
| C. | 20℃10 mL 4mol/L的X溶液 | D. | 10℃10 mL 2mol/L的X溶液 |
| A. | 乙醇 | B. | 盐酸 | C. | 一氧化碳 | D. | 硝酸 |
| A. | 符合同一通式的物质 | |
| B. | 含有相同官能团的物质 | |
| C. | 相对分子质量相差14或者14的倍数的物质 | |
| D. | 通式为CnH2n+2,且C原子数不相等的物质 |

已知:部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al2+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与Na2CO3反应的离子方程式是Co2O3+SO32-+4H+=Co2++SO42-+2H2O.
(3)步骤Ⅲ中若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+6H++5Cl-=3Cl2↑+3H2O,其中,Na2CO3溶液的作用是调节溶液PH使铁离子沉淀完全转化为Fe(OH)3.
(4)在空气中加热草酸钴晶体(CoC2O4•2H2O)样品需要用到的主要仪器是坩埚,5.49g该晶体受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
(5)从反应后的混合物中得到草酸钴晶体,需对晶体进行洗涤,证明晶体已经洗涤干净的操作及现象是取最后一次洗涤液于试管中,加入几滴稀硝酸酸化的硝酸银溶液,若无白色沉淀生成,说明已经洗净.
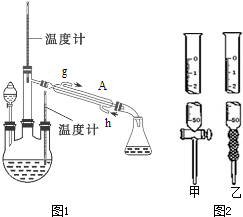

 +2Br2→
+2Br2→ +2HBr
+2HBr
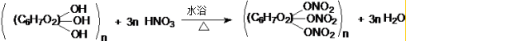 .
.